- Educație generală. formarea gândirii elevilor prin activarea ideilor despre relația dintre structura materiei și proprietățile ei, familiarizarea studenților cu istoria descoperirii benzenului, proprietățile sale fizice și chimice, metodele de producție. Pentru a da o idee despre aroma, legătura aromatică. Introducerea teoriei moderne a structurii electronice a benzenului.
- Dezvoltarea. dezvoltarea de abilități și abilități de lucru cu un laptop, cu publicații electronice, dezvoltarea interesului cognitiv al studenților, creșterea inteligenței.
- Educaționale. formarea unei viziuni științifice, creșterea capacității de a lucra în perechi, simțul mândriei în realizările științei, inculcarea interesului în subiect.
I. Momentul organizatoric
Salut, verificând pregătirea elevilor pentru lecție, creând motivație pozitivă pentru lecția viitoare.
II. Repetarea temelor abordate (ancheta frontală, activitatea studenților la bord)- Definiți hidrocarburile limitative și nesaturate, caracterizează clasificarea substanțelor;
- Alcani, alchene, alchine: comparați tipul de hibridizare, unghiul valenței, lungimea legăturii;
- Identificați tipurile de reacții chimice pentru hidrocarburi;
- Scrieți ecuațiile reacțiilor caracteristice pentru hidrocarburi.
III. O prezentare a unui nou subiect
- soluția problemei determinării formulei moleculare a materiei
- moduri de producere a benzenului
- proprietățile fizice ale benzenului
- impact asupra corpului uman
- structura benzenului - formula structurală
- teoria modernă a structurii electronice a benzenului
- chimice ale benzenului

Ce asociații cauzează aceste diapozitive?
Imaginați-vă Anglia la începutul secolului al XIX-lea. Deja în 1814, străzile și digurile din Londra au fost aprinse de lanternele de gaze seara. În arzătoarele speciale de lămpi stradale, gazul ușor obținut din balene și grăsime de cod a fost ars. Dar nu toți locuitorii Albionului cețos erau mulțumiți de noul iluminat. Walter Scott a scris: "Lumea sa întors cu susul în jos, Londra va fi aprinsă cu fum de cărbune." Și producătorii de lumanari au distrus deschis felinarele noi. În plus, "gazul de lumină" a avut un dezavantaj semnificativ: în nopțile de vară, iluminatul era strălucitor, iar iarna, în frigul sever, a devenit rapid diminuat. Gazul nu a dat lumină puternică, astfel încât locuitorii Londrei nu erau atât de fericiți să meargă pe malurile Tamisei. Proprietarii centralei de gaze au apelat la ajutorul omului de știință faimos M. Faraday.
În 1825, Faraday a stabilit că o parte din gazul de lumină este colectată în partea de jos a cilindrului sub forma unui lichid transparent. Cercetătorul a stabilit compoziția calitativă și cantitativă a acestei substanțe și a numit-o "hidrogen carburat", deoarece a inclus atomii de carbon și hidrogen. Numele noii substanțe s-a schimbat de mai multe ori. Eilgard Mitcherlich la numit benzină. În curând, Justus Liebig a redenumit benzenul (de la arabă. Ben-aroma + zoa-suc + lat.ol (eum) -il). În 1837, odată cu depunerea lui Auguste Laurent, a apărut un alt nume - un uscător de păr (de la lampa greacă.phenix), ca semn că benzenul se găsește în gazul ușor.
Deci, această substanță este benzen!
Astăzi, fără ea, nu renunța la primirea multor medicamente, parfumuri, coloranți diferiți. Se utilizează ca solvent, ca aditiv la combustibilul pentru motor. Rolul derivatelor de benzen în agricultură este mare, cu condiția ca acestea să fie utilizate rațional. Și deși nu avem de-a face cu el, derivatele sale - aspirină, vanilină, efedrină și altele - au fost de mult timp incluse în viața noastră.
Printre cele peste 25 de milioane de compuși organici cunoscuți până în prezent, există puțini care au avut un impact mai mare asupra dezvoltării chimiei organice decât benzenul! Pentru a explica structura și proprietățile sale, au fost prezentate mai multe teorii, dintre care cele mai multe nu au stat testul timpului și sunt cunoscute numai de istoricii chimiei.
Benzenul din chimia organică este la fel de important ca și acidul sulfuric în chimia anorganică. Și dacă acesta din urmă este cunoscut de chimiști, deoarece cele mai vechi timpuri, benzenul a fost descoperit abia la începutul secolului al 19-lea, la începutul nașterii noua chimie - este cel care conduce astăzi, cea care este asociată cu apariția unor diverși polimeri, țesături sintetice, fibre sintetice coloranți, exact cel care ne-a schimbat atât de dramatic viața spre bine.
Iar drumul către diversitatea produselor chimice constă tocmai prin benzen - un lichid fără marcă, pe care numele nu i-a dat-o imediat, formula nu a putut fi determinată și structura a fost un mister și subiect al numeroaselor discuții științifice!
Sarcina: Determinați formula de substanță descoperită de Faraday dacă se știe că 92,3% carbon și 7,7% hidrogen sunt incluse în compoziția sa, iar greutatea moleculară relativă a substanței este 78.

Astfel, C6H6-benzenul este un lichid insolubil în apă, incolor, incolor, cu un miros aparte.
Mulți derivați de benzen au, de asemenea, o aromă plăcută, uneori foarte plăcută, astfel încât aceste hidrocarburi erau numite "aromatice" (la sugestia lui A. Kekule-1860). Mai târziu sa dovedit că majoritatea substanțelor care, în funcție de structura și proprietățile lor, aparțin aceluiași grup, nu au un miros parfumat, dar numele istoric format al acestor compuși a supraviețuit până în prezent. Benzolul poate fi considerat drept strămoș al acestor compuși.
Benzenul are un efect nociv asupra corpului uman: provoacă daune sistemului circulator și sistemului nervos, tractului gastrointestinal. Este cancerigen, adică o substanță care, în contact repetat cu corpul, promovează creșterea tumorilor maligne. Mai ales această influență asupra unui organism tânăr. Astfel, în ciuda importanței enorme a benzenului și a compușilor săi în viața oamenilor, acesta este capabil să dăuneze oamenilor!
Prin conținutul de atomi de hidrogen din moleculă, a fost clar că hidrocarburile aromatice au un caracter nesaturat. Pentru benzen și pentru omologii săi, întregul arsenal existent al metodelor de investigare, chimice și fizice, a fost eliminat. Spre surprinderea tuturor, substanța nu a avut tendința de reacții aditive, adică nu seamănă cu alkenurile, dar în funcție de reacțiile sale tipice de substituție, era mai mult ca alcani. Istoria fascinantă a stabilirii formulei structurale de benzen a început.
Având în vedere formula generală a benzenului și natura sa foarte nesaturată, este posibil să se compună astfel de izomeri structurali:
Dar care dintre ele corespunde adevărului? FAKekule sa reflectat mult pe structura benzenului. Odată ce a trebuit să fie martor în judecarea cazului de ucidere a contesei Görlitz. În acest proces, ca indiciu, inelul contesei a fost prezentat sub forma a doi șerpi întrețesute. Acești șerpi s-au prăbușit în memoria omului de știință.
Din memoriile lui FA. Kekule „Laboratorul meu este situat în aleile, și chiar și în timpul zilei nu a fost slabă pentru chimist, care își petrece zile întregi în laborator, nu a fost un obstacol făceam de lucru la manualul său, dar ceva ma împiedicat, și gândurile mele undeva .. apoi a crescut. M-am întors scaunul meu la foc și ațipi. atomii de carbon și hidrogen, au dansat în fața ochilor mei. șuvițe lungi se apropie foarte des și se rostogolească în sus într-un tub, care seamănă cu doi șerpi. Dar ce este? Unul dintre ei a luat propria coadă, încă mai bate joc vîrtej înaintea ochilor mei. M-am trezit și de data aceasta a petrecut restul nopții pentru a studia consecința ipoteza mea. "
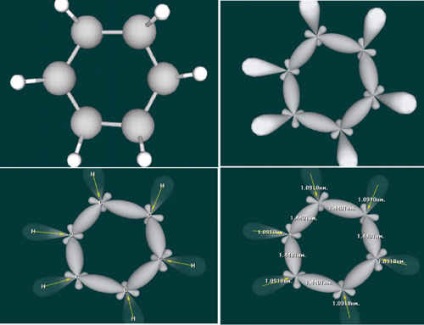
Visul era profetic! Kekule a blocat toți atomii de carbon într-un hexagon cu legături duble și simple alternante.
A fost propusă formula structurală a benzenului. De mai bine de 100 de ani, chimiștii au folosit formula Kekule, deși este contradictorie. Numeroase fapte au împins chimiștii la ideea că nu există legături simple sau duble în benzen și există "unu și jumătate". Acest lucru a fost propus de Tile la începutul secolelor al IX-lea și al XX-lea. El a susținut că atomii de carbon sunt legați prin legături simple, iar valențele reziduale sunt distribuite uniform în întregul inel. Nouă valențe reprezintă șase atomi - așa se dovedește că legăturile din molecula de benzen sunt "una și jumătate". După aceea, formula benzenului a fost prezentată ca un hexagon cu un inel.
Această imagine a fost mai mult decât corectă. Folosind observații fizice sofisticate, sa constatat că șase electroni din „extra“ obligațiuni (două per legătură) formează o singură structură: TN „nor electronic unic“, care a devenit compus aromaticitate simptom. Aproape un secol de cercetare asupra benzenului a fost finalizat.
Mulți chimici remarcabili au studiat natura legăturilor duble în benzen, abordând treptat înțelegerea structurii reale a moleculei sale. Ideea modernă a naturii comunicațiilor electronice în benzen se bazează pe ipoteza unui fizician american proeminent și chimist Linus Pauling, de două ori câștigător al Premiului Nobel. A fost la propunerea lui depictions molecula de benzen sub forma unui cerc hexagon inscripționată, subliniind astfel absența legăturilor duble fixe și având nor de electroni uniform acoperind toți atomii de inel șase carbon.
Kekule avea dreptate: molecula benzenului are o structură ciclică, toți cei șase atomi de carbon se află în același plan. Fiecare atom de carbon este într-o stare de hibridizare sp2, deoarece este legat de încă doi atomi de carbon și un atom de hidrogen.
În plus, fiecare atom de carbon are o p-orbită care nu participă la hibridizare. Are formă de opt voluminoase. Șase astfel de nori de electroni se suprapun pentru a forma un singur sistem P în care densitatea electronului este distribuită uniform între toți cei șase atomi de carbon și, prin urmare, toate legăturile dintre atomii de carbon sunt exact aceleași.
În legătură cu această imagine mai precisă a benzenului este un hexagon cu un cerc interior.
(Elevii sunt invitați să lucreze cu CD-ul „Virtual Lab“ pentru a „molecule de designer“. Elevii adună modele dinamice, tridimensionale ale moleculei de benzen, având în vedere modelul structural, norul hibrid.)
Bomboane de ochi după ce au lucrat cu laptop-uri (Anexa 1)
Prin proprietăți chimice, benzenul ocupă o poziție intermediară între alcani și alchene. Astfel, proprietățile benzenului sunt afectate de caracteristicile structurii sale electronice.
Benzenul nu decolorează soluția de permanganat de potasiu. Clorul poate să se alăture benzenului, dar reacția are loc numai prin iradierea intensă a amestecului.
Reacția de adăugare de hidrogen la benzen se efectuează sub presiune și cu încălzire.
Astfel, reacțiile de adiție pentru benzen se desfășoară mai greu decât pentru alchene.
Și reacțiile de substituție sunt mai ușor decât pentru alcani.
Benzenul - cea mai importantă materie primă pentru industria chimică, deoarece este utilizat ca reactiv de pornire (aproape toate materialele sintetice moderne conțin, de obicei grupări aromatice), și ca solvent pentru alte substanțe (benzen se dizolvă aproape toți compușii organici, este un fel de „apa organice „). Aici numai sintezele de bază care implică benzen: Prepararea fenol, acid benzoic, anilină, rășini fenol-formaldehidice, tipuri speciale de cauciuc, toluen, și deci exploziv (trinitrotoluen), medicamente (aspirina, de exemplu). Puteți enumera foarte mult timp.
Benzenul și derivații săi sunt utilizați pe scară largă în economia națională.
Benzenul servește drept materie primă pentru sinteza multor compuși organici: medicamente, parfumuri, coloranți, solvenți, polimeri. Folosit ca aditiv la combustibilul pentru motor pentru a-și îmbunătăți proprietățile.
benzen clorurat, utilizate în agricultură ca produse de protecție a plantelor, pentru tratarea uscată a semințelor de grâu și secară împotriva tăciunele urât mirositoare, pentru a combate filoxera în vii.
Întrebări pentru remediere.- Care sunt proprietățile fizice ale benzenului?
- Care este contradicția dintre formula structurală a benzenului și proprietățile sale?
- Formula structurală a benzenului este reprezentată ca un hexagon cu un cerc interior. Ce înseamnă acest cerc?
- Care este asemănarea benzenului cu alcani și alcene?
- Am învățat multe lucruri noi.
- A fost interesant.
- A fost ceva de gândit.
- Lucrat cu bună-credință.
- Mi-a plăcut lecția.