definiție
PH-ul este definit ca logaritm negativ al activității ionului de hidrogen, aH +, în soluție. Astfel: pH = - log (aH +)
Tehnologia de măsurare PH
PH-ul este măsurat prin instalarea a doi electrozi: un electrod de măsurare și un electrod de referință. Acești doi electrozi sunt adesea combinați într-unul, care se numește "electrod combinat". Toți electrozii de pH furnizați de FLS sunt "combinați".
Când cei doi electrozi sunt imersați în soluție, se formează o celulă galvanică mică. Potențialul dezvoltat depinde de ambii electrozi.
Tensiunea măsurată poate fi exprimată prin ecuația Nernst după cum urmează:
E = Emeas - Eref = E0 - (2,303RT / F) pH unde
E = tensiunea măsurată
Emeas = tensiunea electrodului de măsurare
Eref = tensiunea electrodului de comandă
E0 = potențialul electrodului standard
R = constanta gazului
T = temperatura absolută
F = constantă Faraday
În plus, aceasta înseamnă că relația dintre pH și E este corelată liniar cu temperatura.
Panta caracteristică la + 25 ° C este de 59,18 mV / pH. Este de aproximativ 54 mV / pH la + 5 ° C și aproximativ 62 mV / pH la + 40 ° C. La + 100 ° C, abrupta creste la aproximativ 74 mV / pH.
Termeni tehnici pH
Determinarea deviației și abrupței curbei sistemului pH.
Pentru a evalua performanțele ambelor electrozi, calibrarea ar trebui efectuată pentru ambele puncte de pH.
Calibrarea pe o soluție de probă poate fi efectuată pentru a investiga substanțele chimice care pot afecta măsurarea pH-ului.
soluție de calibrare (lichide tampon)
O soluție cu o valoare cunoscută a pH-ului utilizată pentru calibrarea sistemului pH.
Soluțiile de calibrare sunt afectate de temperatură.
Dependența lichidului tampon de temperatura este bine cunoscută.
Dependența lichidelor tampon furnizate de FLS este indicată în continuare:
Pentru comparație, valorile pH-ului se corelează deseori cu o anumită temperatură, de obicei + 25 ° C.
compensarea automată a temperaturii
Algoritmi pentru conversia automată a unei probe de pH la o temperatură de referință.
Această funcție ia în considerare modificările în curba pH-ului în funcție de temperatură.
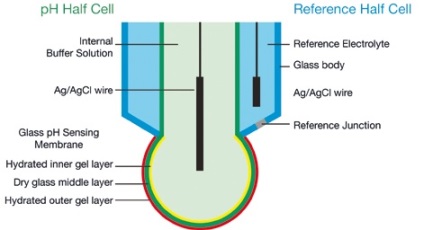
Principiul funcționării electrodului pH
Electrodul de pH este o celulă electrochimică cu impedanță foarte înaltă, în care potențialul format între pH-ul semi-celular și jumătatea celulei de referință este suma diferitelor potențiale. Figura A prezintă un electrod de pH combinat cu sticlă obișnuită, în care celula jumătății de pH și jumătatea celulă de referință sunt combinate în aceeași construcție.
În mod ideal, toate potențialele sunt constante, cu excepția celui generat pe stratul de gel hidratat exterior, care depinde de proba pH conform ecuației Nernst.
Electrozii reali diferă de un electrod ideal datorită mai multor factori, printre care:
1) toleranțe de producție;
2) îmbătrânirea electrodului;
3) restaurarea și curățarea electrodului.
Toate contoarele pH permit calibrarea sau standardizarea electrodului pentru a compensa efectele menționate mai sus. calibrare standard cuprinde măsurarea unui răspuns al electrodului la două tampoane de pH cu valori cunoscute ale pH-ului, și crearea de hărți de răspuns electrod liniare pentru aceste două puncte. Aceste rezultate ca o abatere Coeficienți de corecție și panta curbei, unde abaterea este o cartografiere a mV la pH 7, iar panta curbei este modificarea răspunsului per unitate de mV pH, de obicei exprimat în mV / pH, reprezintă procentul curbei ideale pantei electrodului (59,16 mV / pH la + 25 ° C).
Măsurarea AFP
definiție
Potențialul de reducere a oxidării (ORP) este o măsură a tendinței soluției de a oxida sau de a deoxida ceea ce poate fi în contact cu acesta.
Soluția de oxidant este un lichid care tinde să obțină electrozi care oxidează ceea ce este în contact cu ei, deoxidându-se.
Soluția de dezoxidare este un lichid care are tendința de a pierde electrozi care deoxidizează ceea ce este în contact cu ei, oxidându-se pe ei înșiși.
AFP tehnologie de măsurare
Electrodul ORP generează o tensiune, precum și un electrod pH. În acest caz, măsurarea este afectată nu numai de ionii de hidrogen, ci și de toate substanțele chimice care pot da sau primi electroni.
Deși ORP afectat de temperatura și, în principiu, ar trebui să fie ecuația Nernst, este dificil să compenseze măsurarea, deoarece de obicei nu se știe câți electroni sunt implicate în reacțiile redox (când măsurarea ORP este folosită numai pentru monitorizarea reacției poate determina rădăcină implicată reacția jumătate, și, prin urmare, poate fi do).
În măsurarea ORP, se utilizează și instalarea a doi electrozi: un electrod de măsurare și un electrod de referință. Acești doi electrozi sunt adesea combinați într-unul, care se numește "electrod combinat". Toți electrozii ORP furnizați de FLS sunt "combinați". Când cei doi electrozi sunt imersați în soluție, se formează o celulă galvanică mică.
Potențialul dezvoltat depinde atât de electrozi, cât și, de regulă, este de la -1000 mV până la +1000 mV.
Cu toate că această măsurătoare nu este asociat cu un anumit fluid poate fi foarte util pentru monitorizarea și controlul activității anumitor compuși. În practică, utilizarea de monitorizare și control al reacțiilor de oxidare-dezoxidare utilizate la distrugerea cianurii, declorinare, nitrit și oxidarea sulfit, cromatul dezoxidare, albire hipoclorit și de asemenea pentru monitorizarea epuratoare de dioxid de clor și clor folosind bisulfit ORP. măsurarea concentrației cu AFP problematice, dar ORP pot fi utilizate în unele cazuri pentru a detecta scurgeri, pentru a determina prezența unui oxidant sau dezoxidant.
În cele din urmă, în unele cazuri, se măsoară ORP pentru a regla creșterea biologică a microorganismelor. Principiul unei astfel de aplicații este că microorganismele vor fi distruse cu succes cu o valoare minimă a ORP. Această abordare este utilizată în clorinarea bazinelor de înot și turnurilor de răcire. Trebuie remarcat faptul că în ambele aceste aplicații se efectuează ajustarea pH-ului.
Termenii tehnici ai AFP
Determinarea deviației sistemului ORP.
Pentru majoritatea aplicațiilor AFP, precizia absolută este mai puțin importantă decât viteza și schimbările relative ale sistemului. Pentru mai multe valori dorite ale procedeelor și specificațiilor cerute cu ORP o toleranță de ± 25 mV și ± 50 mV, sau modificări care identifică în ORP, de exemplu, o picătură de 400 mV, valoarea finală. Deoarece indicatorul este utilizat într-o varietate de cazuri AFP, cu metodele lor proprii de specialitate de lectură performanțele sau modificările indicatorilor, pe baza experienței, nu putem dezvolta tehnica in detaliu. Este suficient să spunem că precizia necesară pentru măsurarea pH-ului și a altor măsurători electrochimice care nu sunt de obicei utilizate pentru ORP, astfel încât electrozii de calibrare și ORP de metri nu este atât de comună.
O soluție cu o valoare ORP cunoscută pentru verificarea sistemului ORP.
După cum sa explicat mai sus, valoarea absolută a ORP nu este atât de importantă, astfel încât soluția de calibrare ORP poate fi utilizată numai în scopul verificării.
În general, soluția de calibrare sau soluția de control a ORP este destinată doar simplificării comparației.
Cu alte cuvinte, o abatere de estimare poate fi obligatorie în cazul înlocuirii electrodului, atunci când un nou senzor măsoară valoare diferită de electrodul anterior, cu toate acestea, calibrarea poate fi necesară pentru a verifica dacă noua valoare cu cea anterioară. De exemplu, dacă procedura necesită valoarea dorită de 410 mV determinat prin utilizarea electrodului precedent și dispozitivul, indicarea unui electrod nou cu același instrument poate crea 425 mV în același lichid. Folosind calibrarea sau, mai precis, abaterea de ajustare poate elimina diferența de 15 mV, pentru a evita confuzia. Apoi, atunci când citiți următoarele citiri, ele pot fi ușor comparate cu citirile electrodului precedent.
Principiul funcționării electrodului OPP
Principiul de măsurare este de a utiliza electrodul ORP metal inert (platină, aur, uneori, mai rar argint) care, datorită rezistenței sale reduse va dona electroni la oxidant sau accepta electroni de la un dezoxidant. electrod ORP va continua să accepte sau să doneze electroni, ca urmare a dezvoltării soluției AFP egale o acumulare de sarcină. De regulă, precizia măsurării ORP este de ± 5 mV. De asemenea electrod ORP necesită un electrod de referință, care este de obicei același electrod de clorură de argint, care este utilizat pentru măsurarea pH-ului.
Măsurarea conductivității
definiție
Conductivitatea este capacitatea unei soluții de a conduce un curent electric. În soluții, curentul este purtat de cationi și de anioni.
Abilitatea unei soluții de a conduce electricitate depinde de o serie de factori:
- concentrare
- Mobilitatea ionilor
- Valence de ioni
- temperatură
Toate substanțele au grade diferite de conductivitate. În soluțiile apoase, nivelul de rezistență ionică variază de la conductivitatea scăzută a apei ultrapură la cea mai mare conductivitate a probelor chimice concentrate.
Tehnologia de măsurare a conductivității
Conductivitatea poate fi măsurată prin alimentarea unui curent electric (I) către doi electrozi imersați într-o soluție și măsurând tensiunea rezultantă (V). În timpul acestui proces, cationii migrează către electrodul negativ și anionii către electrodul pozitiv, iar soluția acționează ca un conductor de energie electrică.
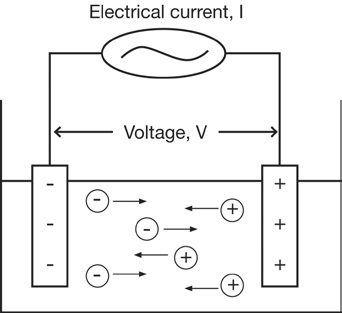
Rezistența soluției (R) poate fi calculată folosind legea lui Ohm
(V = R x I).
R = V / I
în cazul în care:
V = tensiune (volți)
I = curent (amperi)
R = rezistența soluției (ohm)
Conductivitatea (G) este definită ca reciprocitatea rezistenței electrice (R) a soluției dintre cei doi electrozi.
De fapt, contormetrul măsoară conductivitatea electrică și afișează citirile convertite la conductivitate.
Acesta este raportul dintre distanța (d) dintre electrozii și aria (a) a electrozilor.
K = d / a
K = element constant (cm-1)
a = suprafața efectivă a electrozilor (cm2)
d = distanța dintre electrozi (cm)
Electricitatea este fluxul de electroni. Aceasta înseamnă că ionii din soluție vor conduce energia electrică. Conductivitatea este capacitatea unei soluții de a conduce curentul. Citirile conductivității probei variază în funcție de temperatură.
C = G x K
C = conductivitate (S / cm)
G = conductivitatea (S), unde G = 1 / R
K = element constant (cm-1)
Aceasta este inversa valorii conductivității, care este măsurată în ohm-cm. De obicei se limitează la măsurarea apei pure, a cărei conductivitate este foarte scăzută.
Pentru a determina elementul constant, este necesar să se transforme citirile de conductivitate în rezultate de conductivitate.
O soluție cu o valoare de conductivitate cunoscută pentru calibrarea sistemului de conductivitate.
Pentru comparație, valorile conductivității se corelează adesea cu o anumită temperatură, de obicei +18 ° C, + 20 ° C sau + 25 ° C.
compensarea automată a temperaturii
Algoritmi pentru conversia automată a conductivității eșantionului la temperatura de control.
coeficient de compensare a temperaturii
Coeficientul utilizat pentru compensarea automată. De obicei, este exprimată în% / ° C.
Pentru utilizarea cu apă ultrapură (UPW) cu instrumente de măsurare FLS, există o corelație specială bazată pe ASTM D1125-19.
total solide dizolvate (TDS)
Această măsurare a concentrației totale de substanțe ionice din eșantion.
Instrumentul este calibrat în conformitate cu o soluție standard sau cu soluție salină, pe care utilizatorul a decis să o folosească ca probă de control.
Constatările de conductivitate sunt convertite în citiri TDS prin înmulțirea cu ajutorul coeficientului matematic cunoscut. Coeficientul depinde de compoziția de control (de obicei, salină) utilizată pentru a pregăti un material standard sau de control. De exemplu: apa de mare conține multe săruri diferite, dar cea mai mare parte NaCl, astfel încât utilizatorul poate compara numai cu acesta. Iată câteva exemple de coeficienți:
intervalul coeficientului de conversie
Condiții tehnice de conductivitate
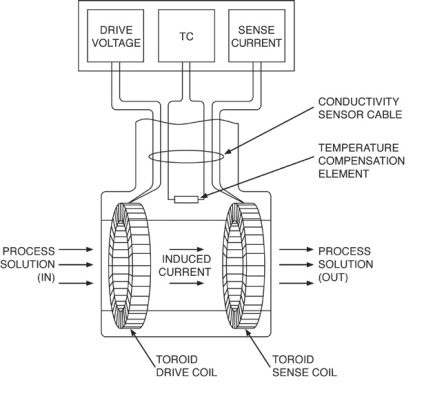
Conductivitate inductiv toroidală
Senzorul inductiv de conductivitate toroidală constă din două toroide (bobine) de înaltă calitate, concentric și una lângă alta, încorporate într-o carcasă neconductoare. Bobina bobinei primare este excitată de o tensiune sinusoidală a curentului alternativ, creând un câmp magnetic alternativ. Acest câmp magnetic alternativ determină ca ionii din soluție să se deplaseze prin centrul toroidului. Mișcarea ionilor este echivalentă cu un curent alternativ care trece prin centrul toroidului. Curentul alternativ produce un curent alternativ în bobina de măsurare, proporțional cu conductivitatea soluției. În mod ideal, semnalul în bobina de măsură ar trebui să fie condiționat numai de mișcarea ionilor și nu de câmpul magnetic alternativ produs de înfășurarea primară. Din acest motiv, este necesară o ecranare magnetică bună între bobine.
Descărcați PDF
Crearea site-ului "Defi"