Dacă într-un vas cu cristale put apa de sare, zahăr, sau permanganat de potasiu (permanganat de potasiu), putem observa modul în care cantitatea de solid scade treptat. Apa în care au fost adăugate cristale, capătă proprietăți noi: apare un gust sărat sau dulce (în cazul colorației permanganat de potasiu purpuriu apare) se modifică densitatea, punctul de congelare etc. Lichidul rezultat nu poate fi numit de apă, chiar dacă acestea nu se pot distinge de apă în aparență (ca în cazul sării și zahăr). Acesta - soluții.
Soluții - sistem multicomponent omogen format dintr-un solvent, soluților și produsele lor de reacție.
Soluțiile nu sunt respectate în orice moment și să rămână omogene. Dacă soluția este filtrată prin densest filtru, fără sare, fără zahăr, fără permanganat de potasiu nu poate fi separat de apă. În consecință, aceste substanțe sunt zdrobite în apă pentru particulele cele mai fine - molecule. Molecule poate asambla din nou în cristale numai când se evaporă apa. Astfel, soluțiile - un amestec molecular.
Starea de agregare pot fi soluții lichide (apă de mare), gazos (aer) sau solide (mai multe aliaje metalice). dimensiunile particulelor în soluții adevărate - mai puțin de 10-9 m (aproximativ dimensiunile moleculare).
Orice soluție constă dintr-un solvent și solutului. În exemplele care solventul este apa. Dar nu este întotdeauna necesar, solventul este apa. De exemplu, se poate obține o soluție apoasă de acid sulfuric. Vor fi solvent de acid. Se poate prepara soluțiile de acid în apă.
Dintre cele două sau mai multe componente ale soluției de solvent este cea care este luată în cantitate ridicată și are aceeași stare fizică ca soluție în ansamblu.
** Există soluții, nu numai lichide, ci și de gaze sau chiar solide. De exemplu, aerul - soluție de oxigen și mai multe gaze din azot. aliaje metalice sunt soluții solide de metale reciproc. Gaza, după cum știm deja, sunt solubili în apă.
Să vedem cum se produce dizolvarea substanțelor. Pentru a face acest lucru, ne uitam cum se dizolvă zahărul adăugat la ceai. În cazul în care ceaiul este rece, zahărul se dizolvă încet. Dimpotrivă, în cazul în care ceaiul este fierbinte și se amestecă cu o lingura, apoi dizolvarea este rapidă.
Odată ajuns în apă, moleculele de zahar de pe suprafața cristalelor de zahăr cu moleculele de apă formează un donor-acceptor (hidrogen) o legătură. In acest caz, o molecula de zahar se leaga de mai multe molecule de apă. Moțiunea termică a moleculelor de apă determină molecula de zahăr asociate să se rupă de cristal și să sară în gros moleculelor de solvent (Fig. 7-2).
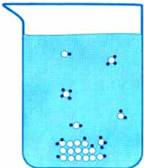
molecule de zahăr care au căzut din cristalul în soluție, se poate deplasa în întregul volum al soluției împreună cu moleculele de apă datorită mișcării termice. Acest fenomen se numește difuzie. Difuzia se produce lent, atât de aproape de suprafața cristalului este deja rupt excesul de cristal, dar încă nu au difuzat în soluția de molecule de zahar.
Ele interferează cu noile molecule de apă să se apropie de suprafața cristalului de contact moleculele sale prin legături de hidrogen. Dacă soluția este agitată, apoi difuzie are loc mai intens și dizolvarea zahărului merge mai repede. Moleculele de zahăr sunt distribuite în mod uniform și soluția devine la fel de dulce pe tot parcursul.
Numărul de molecule capabile să meargă în soluție este adesea limitată. Molecule unei substanțe nu lasa doar cristal, dar, de asemenea, re-alinia cristalul din soluție. In timp ce cristalele sunt relativ puține, moleculele mai mari în soluție decât randamentele din ea - este dizolvată. Dar, dacă solventul este în contact cu o cantitate mare de cristale, numărul de molecule de ieșire și revenirea devine identic cu un observator extern și dizolvare se oprește.
soluții suprasaturate nesaturata, saturate sau dacă particulele moleculare sau ionice distribuite în soluția lichidă sunt prezente în el într-o astfel de cantitate încât în aceste condiții nu dizolvare ulterioară a substanței, numită o soluție saturată. (De exemplu, dacă am pus 50 g NaCl în 100 g H2O, apoi la 20 ° C se dizolvă numai 36 g de sare).
Se numește o soluție saturată, care este în echilibru dinamic cu exces solutului.
Plasarea 100 g de apă la 20 ° C este mai mică de 36 g NaCl obținem o soluție nesaturată.
După încălzire, amestecul de sare cu apă până la 100 # 61616; C se produc dizolvarea 39,8 g NaCl în 100 g apă. Dacă acum îndepărtați sarea insolubilă din soluție, iar soluția a fost răcită la 20 ° C cu atenție, o cantitate în exces de sare nu este întotdeauna precipitat. În acest caz, avem de-a face cu o soluție suprasaturată. Solutia suprasaturată este foarte instabilă. Amestecând, agitare, se adaugă granule de sare poate cauza cristalizarea sării în exces și trecerea la starea stabilă saturată.
soluție Nesaturați - o soluție care conține o substanță mai mică saturate.
soluție suprasaturată - o soluție care conține substanțe mai mari decât saturate.
Dizolvarea ca un proces fizico-chimic
Soluțiile formate prin interacțiunea unui solvent și solut. Procesul de interacțiune a Solvarea solvent și solutului numit (în cazul în care solventul este apa - hidratare).
Dizolvarea are loc pentru a forma diferite forme și produse Forța de aderență - hidrat. Atunci când această forță implicată atât de natură fizică și chimică. Procesul de dizolvare ca urmare a acestor componente interacțiuni însoțite de diferite fenomene termice.
dizolvare a energiei caracteristic este căldura de formare a soluției, considerată ca suma algebrică a efectelor termice ale pașilor endo- și exoterme de proces. Cele mai importante dintre acestea sunt:
- procesele de absorbție de căldură - distrugerea rețelei cristaline, rupe legaturile chimice din molecule;
- procese termice generatoare - formarea produselor de interacțiune a solutului cu solvent (hidrați) și altele.
Dacă energia de rupere a rețelei cristaline este mai mică decât energia de hidratare a solut, dizolvarea merge cu eliberarea de căldură (se observă încălzirea). Astfel, dizolvarea NaOH - proces exoterm: distrugerea rețelei cristaline este irosită 884 kJ / mol, ca și în formarea ionilor hidratați Na + și OH- eliberat, respectiv 422 și 510 kJ / mol.
Dacă energia de cristal energie zabrele de hidratare mai mare, dizolvarea are loc cu absorbție de căldură (în prepararea de scădere a temperaturii soluției apoase NH4NO3 este observată).