Obligatiunile in molecule de hidrocarburi și se poate rupe homolytically heterolytically.
clivaj homolitică de obligațiuni duce la formarea de radicali liberi. Bond este rupt, astfel încât fiecare fragment al moleculei decongelate-oc un electron:
clivaj homolitică apare cel mai frecvent de conversie când termică a hidrocarburilor.
ruptură heterolitice conduce la formarea ionilor. Bond este rupt, astfel încât perechea de electroni este convertit complet la unul dintre mu-atomi, formează o legătură
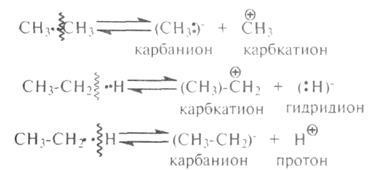
radicali hidrocarbonați, ioni (carbocationilor, carbanioni), hidrogen (H "), gidridion (H :)" și proton (H +) sunt particule intermediare-TION în procesele catalitice transformări termice carbon-hidrogeni. Ei au reactivitate ridicată. deconectării Goethe-rolitichesky apare numai atunci când conversia catalitică a hidrocarburilor. Pe lângă o ruptură completă de obligațiuni pot să apară parțial decalaj lor (decalaj de unul sau un puternic electron-polarizare comunicării), sub acțiunea centrului activ al catalizatorului (acceptor de electroni - A):
deconectare hemolitic necesită mai puțină energie decât hetero-litică, deoarece, în acest ultim caz, energia trebuie să fie cheltuite pentru a depăși interacțiunea electrostatică a ionilor. Mai mult Men-Shai energia necesară pentru a rupe un singur electron (un transfer de electroni). Primul concept de transfer de electroni, cu reacții hetero-litică a fost exprimat OY-Ohlo bystinym 1. cercetătorii sovietici instalate în prezent rolul semnificativ al transferului de electroni în conversia catalitică a hidrocarburilor datorate 2. O caracteristică importantă este energia necesară pentru decalajul hemolitic, numita legătură de energie de disociere.
Trebuie distins conceptul datorită energiei (E) de la conceptele energiei de legătură de disociere ale (D) la molecule complexe (mai mult decât diatomic-TION).
Mismatch energie energie C-H legătură disociere și mijlocul ei, datorită faptului că pentru disocierea moleculei de metan C-H se schimbă sistem con-figurativului valență geometrice stări datorită atomului de carbon. molecula de metan - tetraedru, unghiul dintre valențele este 109 ° 28“. Me-Teal - particule plate. Unghiul dintre valență egal cu 120 °.
Pentru a trece de CH4 molecule tetraedric (sp3 - hibridizarea atomului de carbon) la bromura structura plană (sp 2 - hibridizarea atom de carbon), este necesară energie Dificil-tit astfel încât comunicarea energiei dez gestionate de asociații asupra mass-CH energia conexiunea 1 .
energie egală cu activare de degradare a energiei mo radicalii de pe molecula de legare de disociere au fost reacția radical invers-evaluat este un compus cu energie de activare zero. Prin urmare, pentru determinarea experimentală a disocierii energie ation a C-C trebuie să cunoască dependența constantelor de viteză pentru descompunerea moleculei datorită temperaturii:
unde A - oscilații de frecvență conexiune destructibil octombrie 13c -1. Aceeași ecuație în formă logaritmică este:
Prin construirea acestei relații grafic (Figura 57) definesc o linie tangentă și calcularea unghiului de înclinare D.
Ca alte relații caracteristice (lungime, momentul dipolar, și așa mai departe. D.), energia de legare Disocierea depinde de poziția sa în molecula de hidrocarburi. Tabel. 16 arată disociere energii care legături non-C-C și C-H.
Datele arată că energia de disociere a legăturii C-C variază în funcție de lungimea lanțului hidrocarbonat și legătura polo-zheniya în moleculă. Energia de disociere C-H legătură variază în funcție de natura atomului de carbon - primar, secundar-TION, terțiară. La înlocuirea unui atom de hidrogen pe etan radical de energie ra-disociere a legăturii C-C fenil este redusă comparativ cu etanul nesubstituit. ușurința în general hemolitice legăturile break C-C, și, prin urmare, reducerea de disociere a energiei de comunicație funingine-corespun- este direct dependentă de stabilitatea radicalilor liberi astfel formate. Astfel, comunicarea-TION disociere energetică Salif -Calif - hexaphenylethane numai -42 kJ / mol.
Heterolitice energia de rupere de obligațiuni este mult mai mare decât homolitică. Valorile energiilor decalaj heterolitice svyazeymogut se calculează pe baza potențialului de ionizare a datelor-TION de radicali: R „-> R + + e și energie valorile de obligațiuni homolitică de rupere. Pentru molecule simple, mo-hidrocarburi poate fi găsit experimental (impact de electroni IU-Todd). 2 discontinuitatea Grinsfelderom calculate valorile legăturii centrale molecula heterolitice C-C în hexan. Această valoare este egală cu 1089 kJ / mol. Pentru diferitele legături C-H valoare energetică gap-hetero litică variază 670-1689 kJ / mol.