În jurul miezului într-o traiectorie diferită - Orbitali electronii se deplasează. Fiecare corespunde orbitale la un anumit nivel de energie, mai aproape de miezul orbital, inferior de electroni de energie trebuie să fie pe ea.
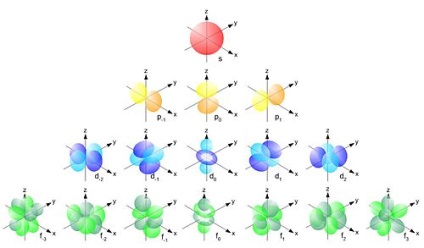
Electronii sunt situate pe orbitalii, în conformitate cu următoarele reguli:
- Principiul energiei minime: în primul rând, electronii ocupă cele mai mici niveluri de energie (de lângă miezul).
nivelurile orbitale de energie și subnivele pentru modificări după cum urmează: 1s <2s <2р <Зs <Зр <4s <3d <4р <5s <4d <5р <6s <4f ≈ 5d <6p <7s <5f ≈6d <7p. (●)
Numărul de orbitali din nivelul de energie
Numărul maxim de electroni în aceste orbitali
Înainte de cele două principii rămase, vom introduce conceptul de electroni de spin. Spin - caracteristici ale electronului, îl prezintă (acest lucru este un model simplificat, și nu un sentiment real fizic al conceptului de rotire!) Poate fi direcția de mișcare a electronului în jurul axei sale sensul acelor de ceasornic sau invers acelor de ceasornic. Valorile posibile sunt doar două: +1/2 și -1/2.
- Principiul Pauli pe fiecare orbital poate fi nu mai mult de doi electroni, cu spatele lor trebuie să fie diferite.
- regula lui Hund: spinul total al sistemului este de a fi cel mai bun posibil.
Luați în considerare umplerea orbitali cu electroni prin mai multe exemple. Fiecare din următorul element din tabelul periodic dintr-un proton și un electron mai mult decât cel precedent. In perioada n-lea sunt umplute cu n-1 niveluri electronice anterioare.
- magneziu - doisprezecelea element de 12 are protoni și electroni. Distribuiți electronii, în conformitate cu (●), fără a uita că fiecare subnivel poate fi nu mai mult de doi electroni.
Magneziu - un element al treilea perioadă, prin urmare, primul și al doilea nivel de energie sunt complet umplute - 1s 2s 2 2 6 .Magny 2p este în al doilea grup, apoi al treilea nivel are doua electroni - 3s 2. TOTAL poluchaem1s 2 2s 2 2p 6 3s 2.
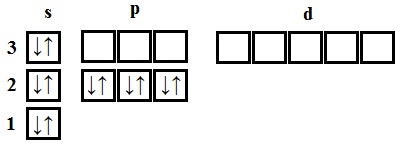
Atomul de magneziu în starea solului, nu există electroni nepereche.
Dacă atomul furnizat energie suplimentară (de exemplu, încălzită), perechea de electroni poate fi aburit si un electron se mișcă la același nivel energetic orbital liber. In starea excitată atomul de magneziu are doi electroni nepereche și pot forma două legături (valență II).
- fosfor - Element al cincisprezecelea 15 distribuie electroni fosfor - element al treilea perioadă, prin urmare, primul și al doilea nivel de energie sunt complet umplute - 1s 2s 2 2 2p 6 .Fosfor stocat în al cincilea grup, apoi al treilea nivel a avut cinci electroni - 3s 2 3. 3P total poluchaem1s 2 2s 2 2p 6 3s 2 3p 3.
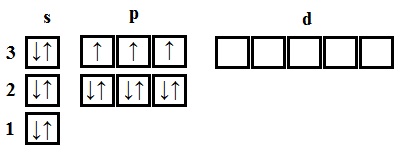
Atomul de fosfor din electron nepereche starea solului 3. In starea excitată a atomului de fosfor are cinci electroni nepereche și poate forma o perioadă de cinci legături (valența V).
- zirconiu - elementul patruzecilea 40 distribuie electroni. Zirconiul - un element al cincilea perioadă, de aceea, primele patru nivele de putere este complet umplut - 1s 2s 2 2 2p 6 3s 3p 2 6 2 4s 3d 4p 10 6 cincilea nivel .Zapolnenie începe cu 5s 2. Zirconiu - al doilea d - element al cincilea perioadă, aceasta înseamnă că conține 2 electroni în 4d - subnivel. Total obține: 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 4p 6 3d 10 4d 5s 2 2.
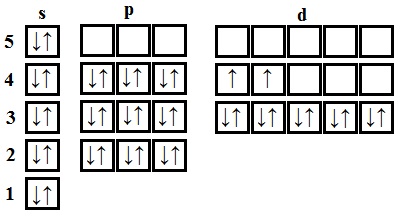
La atomul de zirconiu în starea de bază 2 electroni nepereche.
În zirconiu stare excitată are patru electroni nepereche.
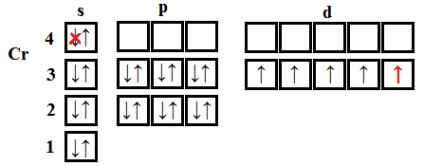
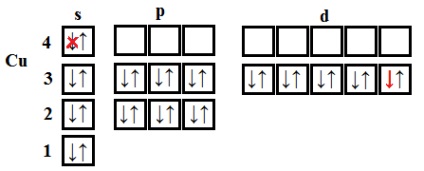
Excepții de la procedura generală pentru completarea subnivele electronice sunt crom, mangan, cupru, argint și aur - au observat „eșecul“ al electronului cu s externi - subnivel la predvneshny d. De exemplu, configurația electronică de crom și cupru, în loc de 2 4s 3d 4 și 3d 9 4s 2 au forma 4s 1 3d si 4s 1 5 10 3d.
Obiective de formare:
- Cât de mulți protoni și electroni cuprinde NO2 ion -
1) 46P, 46e
2) 23P, 24e
3) 23P, 23e
4) 46P, 47e - Diferitele izotopi ai aceluiași element chimic?
1) Numărul de protoni
2) numărul de electroni
3) sarcina nucleului
4) numărul de masă - Se specifică atom, în care majoritatea electronilor:
1) H, 2
2) Ar 40
3) 41 Ar
4) 39 K - Zugrăvi electron atom organigrame clor și în esență toate stările excitate posibile. Care este capabil de a expune valența de clor?
- Explicați de ce sulf are o valență VI și oxigen - nu arată, cu toate că ambele elemente conțin 6 electroni în stratul exterior.
Ai găsit ceea ce căuta? Partajați acest lucru cu prietenii tai!
Sunați-ne: 8 (800) 775-06-82 (apel gratuit în România) +7 (495) 984-09-27 (apel gratuit de la Moscova)