Carbon se găsește în natură, atât în formă liberă și în articulații. Forma liberă se găsește sub formă de modificări alotropice - diamant, grafit, carabină, fullerene.
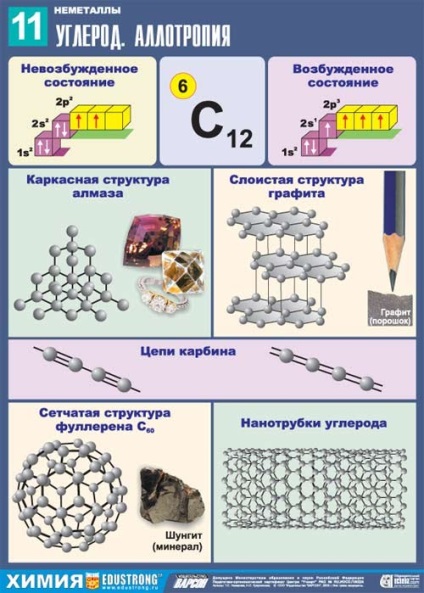
substanță cristalină, transparentă, refracta puternic razele de lumină, foarte solid, non-conductive, slab conductor de căldură, ρ = 3,5 g / cm3; t ° mp. = 3730 ° C; t ° încălzit. = 4830 ° C
Poate fi obținut din grafit p> 50 atm th .; t ° = 1200 ° C
Prafuri abrazive, borax, tăietori de sticlă, după tăiere - diamante.
substanță cristalină, stratificat, opac, gri închis și are un luciu metalic, moale, conduce curentul electric; ρ = 2,5 g / cm3.
Electrozi, mine de creion, moderator de neutroni în reactoare nucleare, parte a unor lubrifianți.
pulbere neagră; ρ = 2 g / cm3; semiconductoare.
Se compune din lanțuri lineare CEC- = C și C = C- = C = C = C =.
Când este încălzit, se transformă în grafit.
La sfârșitul anilor '80 ai secolului XX sa descoperit o altă modificare alotropic - Fuller. Acesta, spre deosebire de diamant și grafit, nici atomic zăbrele, molecular și cristal.
atomii de carbon pot forma, de asemenea, un tub gol - așa-numitul nanotub. In prezent, fullerene și nanotuburi sunt considerate ca bază pentru tehnologiile viitoare.
compușii de carbon sunt foarte frecvente :. toate organismele vii, cărbune, turbă, uleiul și altele conțin carbon. Carbon este parte din mai multe materiale anorganice (calcar, creta, marmura, etc.).
PROPRIETĂȚI CHIMICE DE CARBON
Carbon - maloaktiven, rece reacționează numai cu fluor; Reactivitatea se manifestă la temperaturi ridicate.
C 0 - 4 e - → C 4 sau C 0 - 2 e - → 2 C
Monoxidul de carbon (II) - CO
(Monoxid de carbon. Monoxid de carbon. Monoxidul de carbon)
Proprietăți fizice: gaz toxic incolor, fără miros și gust, de ardere cu flacără albăstruie mai ușor decât aerul, este slab solubil în apă. Concentrația de dioxid de carbon în aer 12,5-74% exploziv.
Gradul oficial de oxidare a carbonului 2 nu reflectă structura moleculelor de CO, în care, pe lângă legătura dublă, de cotitură-Call socializării electron C și D, se formează în continuare mecanismul donor-acceptor datorită oxigen perechi de electroni singulară (indicată de săgeată):
În acest sens, molecula de CO este foarte durabil și capabil de a trece printr-o reacție redox numai la mari runde tempera. În condiții normale, CO nu reacționează cu apa, alcalii sau acizi.
Sursa principală a antropogene CO CO care deservesc în prezent, gazele de eșapament ale motoarelor cu ardere internă. Dioxidul de carbon format în timpul arderii combustibilului în motoarele cu ardere internă, la temperaturi setarea unui sistem de alimentare cu aer insuficient sau slab (oxigen insuficient alimentat pentru oxidarea monoxidului de carbon CO la CO2 de dioxid de carbon). In vivo, formate în timpul descompunerii anaerobă incompletă a compușilor organici și arderea biomasei, mai ales în incendiile de pădure și de stepă de pe suprafața Pământului, monoxid de carbon CO.
1) În industria (gazeificatoarele)
CO2 + C = 2CO - 175 kJ
Generatoarele de gaz, uneori prin cărbune înroșit este purjat cu abur:
amestec CO + H2 - numit syn - gaz.
2) In laborator, - descompunerea termică a acidului formic sau acid oxalic în prezența H2 SO4 (conc.):
În condiții obișnuite de CO inert; când este încălzit - agent de reducere;
CO - oxid nesoleobrazuyuschy.
C 2 O + CuO t ˚ C → Cu + C + 4 O2 ↑
3) cu clor (la lumină)
Light CO + Cl2 → COCI2 (fosgen - gaz toxic)
4) * reacționează cu alcalii se topește (sub presiune)
CO + NaOH P → HCOONa (formiat de sodiu)
Impactul monoxidului de carbon asupra organismelor vii:
Monoxidul de carbon este periculos, deoarece face imposibilă sânge pentru a transporta oxigenul la organele vitale cum ar fi inima și creierul. Monoxidul de carbon se combină cu hemoglobina care transporta oxigenul la celulele unui organism, în urma căreia acesta din urmă devine impropriu pentru transportul oxigenului. În funcție de cantitatea de carbon Monoxid de coordonare inhalatorie afecteaza de exacerbează bolile cardiovasculare si provoaca oboseala, dureri de cap, slăbiciune, Efectul monoxidului de carbon asupra sănătății umane depinde de timpul de concentrare și expunerea asupra organismului. Concentrația de dioxid de carbon în aer mai mare de 0,1% duce la moarte în decurs de o oră și o concentrație de 1,2%, timp de trei minute.
Utilizarea monoxidului de carbon:
În principal, monoxidul de carbon este utilizat ca gaz combustibil în amestec cu azot, un aer așa-numita regenerare sau gaz sau un amestec de apă cu hidrogen gazos. În metalurgie pentru recuperarea metalelor din minereuri lor. Pentru metale de înaltă puritate prin descompunerea carbonili.
Monoxidul de carbon (IV) CO2 - dioxid de carbon
Proprietăți fizice: Dioxid de carbon este un incolor, inodor, solubil în apă - un 1V H2O dizolvat 0,9V CO2 (în condiții normale); mai greu decât aerul; . T ° p.t. = -78,5 ° C (CO2 solid numit "gheata uscata"); Ea nu are suport pentru arderea.
Dioxidul de carbon are următoarea formulă structurală și E -