Găsirea substanțelor moleculare cu formula
Pentru a rezolva problemele de acest tip trebuie să știe formulele generale clase sau-Ganic substanțe și formule generale pentru a calcula masa moleculară a acestor clase de substanțe:
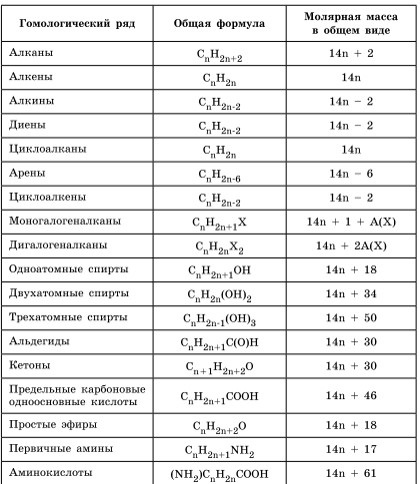
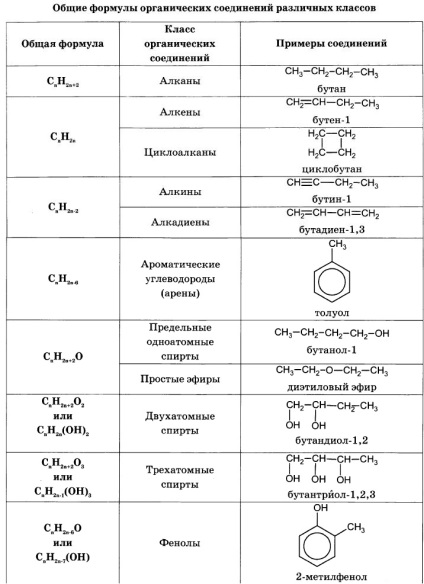
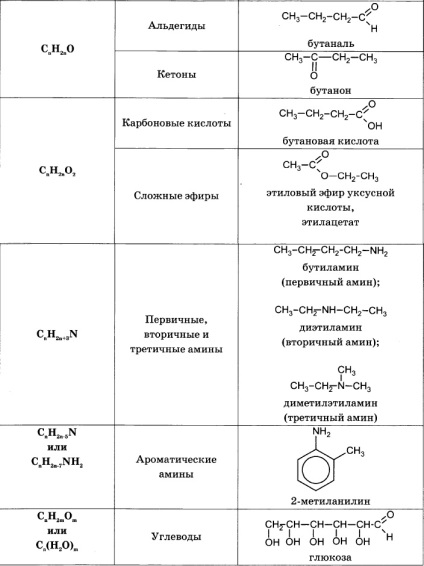
Algoritmul de rezolvare majoritatea problemelor de a găsi o formulă moleculară include următoarele etape:
- înregistrarea reacțiilor ecuații în forma generală;
- determinarea cantității de substanță n, pentru care dat masa sau volumul sau greutatea sau volumul care poate fi calculată din starea problemei;
- determinarea masei molară a substanței M = m / n, formula care ar trebui să fie obosit torsiunii;
- determinarea numărului de atomi de carbon în moleculă și desen clorhidric substanță formula moleculară.
Exemple de soluții sarcină 40 EGE chimie pentru a găsi formula moleculară a unei substanțe organice produs secundar al arderii în explicația
În timpul arderii de 11,6 g de materie organică a produs 13,44 litri de dioxid de carbon și 10,8 g de apă. Densitatea acestui vapori de material din aer este egal cu 2. Se constată că acest material este reacționat cu o soluție amoniacală de oxid de argint este redus catalitic cu hidrogen pentru a forma alcoolul primar, și se poate oxida o soluție acidifiat de permanganat de potasiu la un acid carboxilic. Pe baza acestor date:
1) Setați cea mai simplă formulă a materiei prime,
2) alcătuiesc formula sa structurală,
3) aduc ecuația reacției interacțiunii sale cu hidrogen.
Soluție: Formula generală a materiei organice SxHyOz.
Translate volumul de dioxid de carbon și masa de apă la moli de formulele:
Volumul molar Vm = 22,4 l / mol
n (CO2) = 13,44 / 22,4 = 0,6 mol => în materialul de pornire a conținut un n (C) = 0,6 mol,
n (H2O) = 10,8 / 18 = 0,6 mol => conținută în materialul de pornire de două ori n (H) = 1,2 moli,
Noi știm dacă oxigenul conținut în compusul organic. În acest scop, din greutatea substanțelor organice ia greutate carbon și greutate hidrogen: m (O) = 11,6 - 0,6 * 12 - 1,2 = 3,2 g,
Prin urmare, compusul dorit conține cantitatea de oxigen:
n (O) = 3,2 / 16 = 0,2 moli
Lăsați raportul dintre atomii C, H și O, incluse în substanțele organice inițiale:
n (C). n (H). n (O) = x. y. z = 0,6. 1.2. 0,2 = 3. 6. 1
formula simplă Găsit: C3 H6 O
Pentru a găsi formula adevărată, descoperim că masa molară a compusului organic conform formulei:
M (SxHyOz) = Dvozd (SxHyOz) * M (Air)
Mist (SxHyOz) = 29 * 2 = 58 g / mol
Verificați dacă masa moleculară adevărată masa molară cea mai simpla formula:
N (C3 H6 O) = 3 + 12 * 6 + 16 = 58 g / mol - corespunde => true formula coincide cu cele mai simple.
Formula moleculară: C3 H6 O
Din datele problemei: „substanța reacționează cu o soluție amoniacală de oxid de argint este redus catalitic cu hidrogen pentru a forma alcoolul primar, și se poate oxida o soluție acidifiat de permanganat de potasiu la un acid carboxilic“ concluzionăm că această aldehidă.
2) Prin reacția 18,5 g de limitare acid carboxilic monobazic cu un exces de 5,6 l-au remarcat (STP) de gaz cu soluție de carbonat acid de sodiu. Oprah divide formula moleculară de acid.