Pentru a compara efectele diferitelor procese energetice, efectele termice sunt determinate în condiții standard. Pentru o presiune de recepție standard de 100 kPa (1 bar), o temperatură de 25 0 C (298 K), concentrația - 1 mol / l. În cazul în care materiile prime și produsele de reacție sunt în stare standard, entalpia standardul de formare se numește entalpia standard a sistemului și notat ΔN0298 sau ΔN0.
Ecuațiile reacțiilor chimice care indică efectul termic se numește ecuații termochimice.
Ecuațiile termochimice indică starea de fază și un polimorf de reacție și care formează substanțe -Gaz r, w - lichid la -kristallicheskoe, t - solid, p - dizolvat etc. Dacă starea de agregare a substanțelor în condițiile de reacție, imediat evidente, cum ar fi O2, N2. H2 - gaze, Al2O3, CaCO3 - solide, etc. la 298 K, atunci ele pot fi omise.
Ecuația termochimic include un efect termic? H reacție. care, în termeni moderni este înregistrată lângă ecuație. De exemplu:
Cu ecuațiile termochimice pot funcționa ca și cu ecuații algebrice (adăuga, scade una din cealaltă, înmulțit cu o constantă, etc.).
Ecuația termochimic adesea (dar nu întotdeauna) sunt prevăzute pentru un mol de substanță în cauză (sau de sacrificiu obținut). Cu toate acestea, alți participanți pot intra în ecuație cu coeficienți fracționare. Acest lucru este permis deoarece ecuația termochimică nu funcționează cu moleculele și substanțele cu alunițe.
calcule termochimice
Entalpia standard de formare este determinată atât experimental și folosind un calcule termochimice.
Cele termochimice Calculele bazate pe legea lui Hess (1841):
Căldura de reacție este independentă de modul în care are loc reacția (adică, numărul de etape intermediare), așa cum este determinat de starea inițială și finală a sistemului.
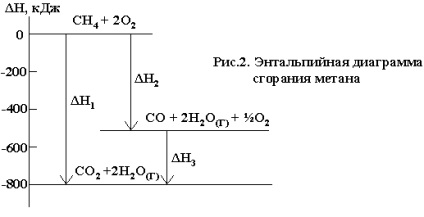
De exemplu, reacția de ardere a metanului poate avea loc conform ecuației:
Aceeași reacție poate fi realizată prin etapa de formare a CO:
Se pare că ΔN01 = ΔN02 + ΔN03. În consecință, căldura de reacție, care curge prin cele două căi este aceeași. legea lui Hess este bine ilustrat de diagramele entalpiei (Figura 2)
și
1. Efectul termic al reacției înainte este efectul termic al reacției inverse cu semnul opus.
2. În cazul în care numărul de reacții chimice succesive, sistemul ajunge la o stare este identic cu originalul, atunci suma efectelor termice ale acestor reacții este zero (? H = 0). Procese în care sistemul după resetări transformări succesive numite procese circulare sau cicluri. Metoda ciclului este utilizat pe scară largă în calcule termochimice.
3. entalpia reacției chimice este suma entalpiile de formare a produșilor de reacție minus suma entalpiile de formare a materiilor prime considerând coeficienții stoichiometrice.
Aici ne întâlnim cu noțiunea de „“ entalpie de formare“.
Entalpie (căldură) formarea unui compus chimic se numește efectul termic al reacției de 1 mol de compus de substanțe simple luate în starea lor de echilibru în aceste condiții. În mod tipic, căldura de formare se referă la starea standard și anume, 25 0 C (298 K) și 100 kPa. Entalpia standard a formării substanțelor chimice notate ΔN0298 (sau ΔN0) măsurat în kJ / mol și conținute în manuale. Entalpia formării de substanțe simple. stabil la 298 K și o presiune de 100 kPa, este luată egală cu zero.
(.? H (H.R)) În acest caz, o consecință a legii lui Hess pentru entalpie standardul de formare are forma: