Hidrogenul H - element chimic, una dintre cele mai comune în universul nostru. masa hidrogenului ca element în compoziția materiei este de 75% din conținutul total de atomi ai unui alt tip. El intră în legătura cea mai esențială și vitală pentru planeta - apa. O trăsătură distinctivă a hidrogenului este, de asemenea, un fapt că el este primul element din tabelul periodic al elementelor chimice D. I. Mendeleeva.

Descoperirea și cercetarea
Prima mențiune a hidrogenului în scrierile lui Paracelsus dată datează din secolul al XVI-lea. Dar izolarea sa dintr-un amestec gazos de aer de cercetare și proprietăți inflamabile a fost făcută în oamenii de știință din secolul al XVII-lea Lemaire. Hidrogenul a studiat temeinic chimist englez si fizician om de știință Henry Cavendish, care sa dovedit empiric că masa hidrogenului mai mică în comparație cu alte gaze. În etapele ulterioare de dezvoltare a științei, mulți oameni de știință au lucrat cu el, cum ar fi Lavoisier, care a numit-o „apa a generat.“
Caracteristică privind situația PSKHE
Element, deschizând tabelul periodic D. I. Mendeleeva - este hidrogen. Proprietățile fizice și chimice ale atomului prezintă anumite dualitate deoarece hidrogenul parte simultan din primul grup, subgrupa principal, în cazul în care se comportă ca un metal și dă un singur electron în procesul reacției chimice și a șaptea - în cazul cochiliei valență umplut complet, adică la recepție particule negative, care se caracterizează ca fiind similar cu un halogen.

Caracteristici ale structurii electronice a elementului
Proprietățile atomului de hidrogen de substanțe complexe la care este inclus și o substanță simplă de H2 sunt determinate în primul rând de configurația electronică a hidrogenului. Particula are un electron, cu Z = (-1), care se rotește în orbita sa în jurul nucleului care conține un proton cu o unitate de masă și sarcină pozitivă (+1). Configurarea electronică 1s 1. înregistrată ca indică prezența unei particule negative în sine, pentru prima și numai din hidrogen s-orbitali.
Când izolarea sau electron reculul și un atom al elementului are proprietatea că se unește cu metale cationi obținute. În esență, ion de hidrogen - este particulă elementară pozitivă. Prin urmare, electronul lipsit de hidrogen numit pur și simplu un proton.
proprietățile fizice
Descrisă proprietăți fizice hidrogen scurt, este gaz incolor, puțin solubil cu o masă relativ atomică de 2, 14,5 ori mai ușor decât aerul, temperatura de lichefiere a -252.8 grade Celsius.
În experiment, puteți face cu ușurință vă că H2 este cel mai ușor. Este suficient pentru a umple cele trei mingi de diferite substanțe - hidrogen, dioxid de carbon, în mod tipic de aer - și în același timp să le elibereze din mâna. Cel mai rapid pentru a ajunge la terenul, care este umplut cu CO2. apoi picături amestec aer suflat conținând H2 și toate conduc la tavan.
O greutate mică și mărimea particulelor hidrogenului justifică capacitatea sa de a penetra prin diverse materiale. Pe exemplul din aceeași minge în acest ușor de a face câteva zile după ce se dezumflă ca pur si simplu de gaz va trece prin cauciuc. De asemenea, hidrogenul se poate acumula în structura anumitor metale (paladiu sau platină), iar atunci când temperatura este ridicată pentru a se evapora din ea.
hidrogen Proprietate utilizate cu moderație în laborator pentru deplasarea ei metoda de izolare a apei. Proprietățile fizice ale hidrogenului (tabelul ilustrat mai jos conține parametrii de bază) definesc domeniul de aplicare și metodele de preparare.
atomi Parametru sau molecule de substanță simplă
Compoziția izotopică
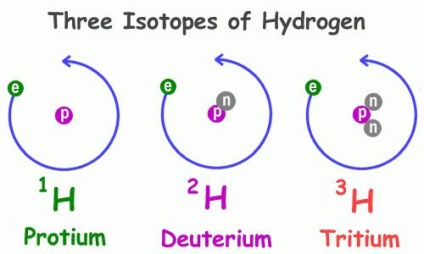
La fel ca mulți alți membri ai sistemului periodic al elementelor chimice, hidrogenul are mai mulți izotopi naturali, adică atomi cu același număr de protoni din nucleu, dar numere diferite de neutroni - particule cu masa zero și unitatea de încărcare. Exemple de atomi având proprietăți similare - oxigen, carbon, clor, brom și altele asemenea, inclusiv radioactive.
Proprietățile fizice ale hidrogenului 1 H, cea mai răspândită a reprezentanților acestui grup sunt semnificativ diferite de cele ale caracteristicilor semenilor săi. În special, diferitele caracteristici ale substanțelor din care fac parte. Astfel, există o apă regulată și deuterată conținând în compoziția sa în locul unui atom de hidrogen cu un singur proton deuteriu 2 H - izotop cu două particule elementare: pozitive și neîncărcate. Acest izotop este de două ori mai mare decât de obicei din hidrogen, ceea ce explică diferența fundamentală în proprietățile compușilor pe care le formează. Natura deuteriului găsit în 3200 de ori mai rar decât hidrogenul. Al treilea reprezentant - tritiu, 3H, în miez are două proton și un neutron.
Metode pentru prepararea și izolarea
Laboratorul și metodele industriale de producere a hidrogenului sunt destul de diferite. Astfel, cantități mici de gaz este produs în principal prin reacții care implică minerale și producția pe scară largă din ce folosind sinteze organice.
Următoarele reacții chimice sunt utilizate în laborator:
- Reacțiile de metale alcaline și alcalino-pământoase cu apă pentru a forma alcaline și gazul dorit.
- Electroliza unei soluții apoase de electrolit, anod standuri H2 ↑ și catod - oxigen.
- Extinderea hidruri de metal alcalin cu apă, alcaline și produsele sunt, respectiv, H2 gaz ↑.
- Reacționând acid diluat cu metale pentru a forma săruri și H2 ↑.
- Acțiunea alcalină pe siliciu, aluminiu și zinc, contribuie, de asemenea, la eliberarea de hidrogen, în paralel, pentru a forma săruri complexe.

In beneficiu gaze industriale obținute prin tehnici cum ar fi:
- Descompunerea termică a metanului în prezența unui catalizator pentru substanțele sale elementare constitutive (350 grade atinge valoarea unui astfel de parametri de temperatură) - hidrogen H2 și C. ↑ carbon
- Transmiterea de vapori de apă prin cocs la 1000 de grade Celsius pentru a forma CO2 și dioxid de carbon H2 ↑ (cea mai comună metodă).
- Conversia gazului metan pe catalizator de nichel, la temperaturi de până la 800 de grade.
- Hidrogenul este un produs secundar în timpul electroliza soluțiilor apoase de clorură de sodiu sau potasiu.
Interacțiuni chimice: dispoziții generale
Proprietățile fizice ale hidrogenului explică în mare măsură comportamentul său în procesele de răspuns cu un anumit compus. Valența hidrogen este 1, deoarece acesta se află în tabelul periodic din primul grup, și prezintă o stare de oxidare diferit. În toți compușii, cu excepția hidruri, hidrogen sd = (1+), în molecule, cum ar fi CN, XH2. HN3 - (1).
O molecula de hidrogen gazos, format prin furnizarea de electroni pereche generalizată, compusă din doi atomi și destul de stabil energetic, din acest motiv, în condiții normale mai inerte în reacție și intră în condiții normale de schimbare. În funcție de gradul de oxidare a hidrogenului și a altor substanțe, acesta poate servi atât ca oxidant și un reducator.
Substanțele care reacționează pentru a forma hidrogen și
interacțiune elementară pentru a forma un complex de substanțe (adesea la temperaturi ridicate):
- Alcalin și metal alcalino-pământos + H = hidrură de.
- Halogen + H2 = halogenhidric.
- Sulful + = hidrogen sulfurat.
- Oxigen + H2 = apă.
- Carbon + H = metan.
- Azotul + H2 = amoniac.
Interacțiunea cu substanțe complexe:
- Prepararea gazului de sinteză de monoxid de carbon și hidrogen.
- Recuperarea metalelor din oxizi lor cu H2.
- saturația de hidrogen din hidrocarburi alifatice nesaturate.
legătură de hidrogen
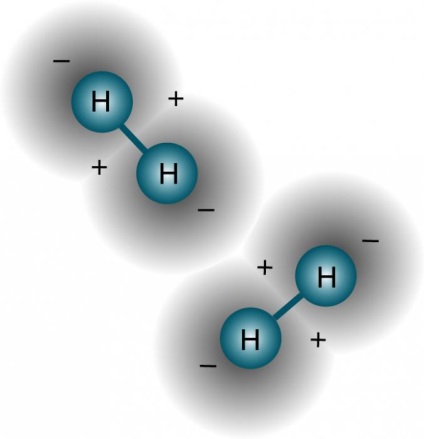
Proprietățile fizice ale hidrogenului sunt de așa natură încât să permită, fiind în legătură cu un element electronegativ, pentru a forma un tip special de legătură cu același atom al moleculelor adiacente având perechi de electroni neîmpărtășite (de exemplu, oxigen, azot și fluor). Cel mai clar exemplu de faptul că este o privire mai bine la acest fenomen - este apa. Se poate spune legături de hidrogen tighelite sunt mai slabe decât covalente sau ionice, dar datorită faptului că multe dintre ele au o influență semnificativă asupra proprietăților substanțelor. De fapt, legătură de hidrogen - este interacțiunea electrostatică, care leagă moleculele de apă în dimeri și polimeri, demonstrând punctul de fierbere ridicat.
Hidrogen în compoziția compușilor minerali
Compozitia acizilor anorganici includ proton - atom de cationi, cum ar fi hidrogenul. reziduu de acid substanță care are un grad de oxidare mai mare de (-1) este respectivul compus polibazic. În prezent există mai mulți atomi de hidrogen, ceea ce face disocierea în mai multe etape în soluții apoase. Fiecare reziduu de acid proton ulterioară separă mai greu. Pentru a cuantifica conținutul de hidrogen în mediu este determinată de aciditatea.

Hidrogenul conțin grupări hidroxil și baze. Acestea sunt conectate la atomul de hidrogen de oxigen, având ca rezultat gradul de oxidare al alcaliilor reziduurilor întotdeauna egal cu (-1). Cu privire la conținutul de grupe hidroxil într-un mediu definit de bazicitate său.
Utilizarea activității umane
Cilindri cu o substanță, precum și recipientele cu alte gaze lichefiate, cum ar fi oxigenul, au un aspect specific. Ei au pictat o culoare negricios-verde, cu un roșu „hidrogen“, cu litere luminoase. Gazul este injectat în balon, la o presiune de aproximativ 150 de atmosfere. Proprietățile fizice ale hidrogenului, în special ușurința stare agregare gazoasă și se folosește pentru umplerea lor cu un amestec de baloane cu heliu, baloane de sondare, etc.
Hidrogen, proprietățile fizice și chimice care oamenii au învățat să folosească mulți ani în urmă, la moment implicat în multe industrii. Masa sa principală se duce la producerea de amoniac. De asemenea, hidrogenul este implicat în producerea metalelor (hafniu, germaniu, galiu, siliciu, molibden, tungsten, zirconiu și altele) ale oxizilor, vorbind în reacție ca agent reducător și o sare a acidului cianhidric, alcool metilic și combustibil lichid, de asemenea, sintetic. Industria alimentară se folosește pentru a transforma uleiurile vegetale în grăsimi solide.
Proprietățile chimice definite și utilizarea hidrogenului în diferite procedee de hidrogenare și hidrogenarea grăsimilor, cărbune, hidrocarburi, uleiuri și păcură. Cu el produc pietre, incandescent, petrece forjare și sudarea produselor din metal sub influența flăcării oxigen-hidrogen.

12 lucruri pe care nu ar trebui să cumpere second-hand A se vedea o listă de lucruri pe care ar trebui să fie întotdeauna în stare proaspătă, și nu le cumpere la mâna a doua.
