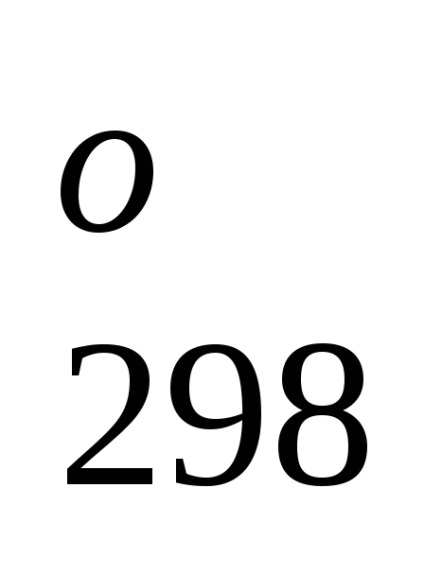Indice 54 este: Dr. tehn. Științe, prof. Lovshenko FG,
Cand. tehn. Stiinte, Assoc. Lovshenko GF
Liniile directoare sunt termodinamica de bază. Exemplele de soluții la problemele tipice. Condițiile de sarcini pentru muncă independentă.
art Examinator. Ven. Patsey VF
Responsabil pentru eliberarea Lovshenko GF
PROCESE energie chimică. afinitate chimică
Semnat în format de imprimare 60x84 1/16. hârtie offset. sablon
Cond. Pec. l. Ouch. out. L. Circulation 215ekz. Număr de comandă _______
Publisher și tipărirea de:
Instituția de stat de învățământ superior
Procese chimice Energie
Chimice termodinamica studierea tranzițiile chimice de energie în alte forme - termice, electrice etc. legile cantitative ale acestor tranziții-gura navlivaet, precum și direcția și amploarea-ing flux reacțiile chimice spontane în condiții specificate ...
Obiectul de studiu in termodinamica unui sistem.
Sistemoynazyvaetsya agregate sunt substanțe inter-acțiune, mental (ilifakticheski) detașat mediu otokruzhayuschey.
sisteme trifazate Etochast omogene la toate punctele de compoziție și proprietăți este separată de alte porțiuni ale suprafeței secțiunii sistemului.
Se face deosebirea între tema ATI omogenă și eterogenă. Sistemele omogeni sunt compuse dintr-o singură fază, eterogenă - a două sau mai multe faze.
Același sistem poate fi diferit în niyah, constând. Fiecare stare a sistemului se caracterizează printr-un anumit set de parametri termodinamici. Pentru a parametrilor termodinamică ică includ temperatura, presiune, densitate-Ness, concentrare și m. P. se modifică cel puțin un parametru termodinamic determină doar o modificare a stării sistemului în ansamblu. Starea termodinamică a vayutravnovesnym numit-sistem în cazul în care este caracterizat printr-o constantă de-ter parametri termodinamic în toate punctele sistemului și nu se schimbă în mod automat (fără cheltuieli de muncă). In termodinamica proprietățile chimice ale sistemului sunt discutate în starea sa de echilibru.
În funcție de condițiile de sistem de trecere de la o stare la alta in termodinamica distinge izotermă, izobară, și a proceselor adiabatice izocoră. Trans-tiile - proceda la o temperatură constantă (T = const), Auto-secară - la presiune constantă (p = const), iar altele - la un volum constant (V = const), a patra - în absența schimbului de căldură între sistem și mediu (q = 0).
Reacțiile chimice apar deseori în condițiile izobare-izotermă (p = const, T = const). Astfel de condiții sunt respectate, în cazul în care interacțiunea dintre substanțele efectuate în vase deschise, fără încălzire sau la o temperatură constantă, dar mai mare.
Energia internă a sistemului.
În tranziția de la o stare la alta schimbare unele dintre proprietățile sale, în special interior-Ness energiyaU.
Vnutrennyayaenergiyasistemypredstavlyaet co-bout energia sa totală, care constă în energii potențiale kineticheskoyi de molecule, atomi, nuclee, electronic-Tron et al. Energia internă cuprinde translatie TION energie, mișcările de rotație și oscilatorii și potențiale, energia potențială, cauzată de forțele de atracție și datul din cap-dezgheață care acționează între moleculele, atomii și particulele intra-atomice. Aceasta nu include starea sistemului în spațiul de energie potențială și energia cinetică a sistemului de mișcare-zheniya ca întreg.
Energia internă absolută a sistemului nu poate fi determinată, tributed, dar poti masura U schimba în timpul tranziției de la un stat la altul. Valoarea este considerată pozitivă U-TION (U> 0) dacă orice energie internă proces crește sistemului.
Energia internă este termodinamicheskoyfunk-tsieysostoyaniyasistemy. Acest lucru înseamnă că, de fiecare dată când sistemul este în această stare, este nevoie de o anumită energie internă inerente în această stare ZNA-chenie. Prin urmare, variația energiei interne nu depinde de calea și metoda de tranziție de la o stare la alta, iar sistemul determinat de diferența de energie internă a celor două state:
în cazul în care U1 și U2- energia internă a sistemului în cele din urmă și începutul domnului state, respectiv.
În orice proces respectat legea conservării energiei. exprimată prin ecuația
ceea ce înseamnă că căldura q, furnizată în sistem, FLOW-mended pentru a crește sistemul său intern de energie și U de notare funcționează A asupra mediului. Ecuația (2) - o expresie matematică a primei legi a termodinamicii.
Din prima lege a termodinamicii implică faptul că incrementarea sistemului energetic intern U în orice proces încă coli de căldură funcționare mesaj de sistem q minus numărul unei operațiuni de sistem perfect; deoarece valorile q și A-se sub măsurarea directă, folosind ecuația (2), este întotdeauna posibil să se calculeze valoarea U.
Prima lege a termodinamicii la podrazume locul de muncă și, prin suma tuturor tipurilor de muncă împotriva forțelor care acționează din partea sistemului de mediu. Această sumă poate merge și să lucreze împotriva forțelor unui câmp electric extern, și să lucreze împotriva forțelor câmpului gravitațional, și activitatea de expansiune împotriva forțelor de presiune externe și alte activități.
Datorită faptului că pentru majoritatea reacțiilor chimice sunt caracterizate prin activitatea de expansiune, este de obicei izolată din cantitatea totală de:
unde A „- toate tipurile de muncă, în plus față de activitatea de expansiune;
p - ei externă presiune;
Dacă în timpul curgerii unui reniu extensie proces operație este singurul tip de operațiune, ecuația (3) devine
Apoi expresia matematică a primei legi a termodinamicii-Omy (2) poate fi scrisă ca:
în cazul în care QP - căldura furnizată în sistem la o constantă emanații lenii.
Substituind H entalpie în ecuația (6), obținem
t. e. căldura furnizată în sistem la presiune constantă, este cheltuit pe schimbarea sistemului entalpie.
La fel ca și pentru energia internă, valoarea absolută a entalpiei unui sistem nu poate fi determinată experimental, dar este posibil prin măsurarea valorii QP, găsi N schimbare de entalpie în timpul tranziției de la un stat la altul. Valoarea N este considerat pozitiv (N> 0), în cazul în care entalpia sistemului vozras-topiturile. Deoarece valoarea N determinată de diferența (H2-H1) și este independentă de calea și modul de realizare a procedeului, entalpie și energia internă cum ar fi, se referă la starea termodinamică sistem funcție-tsiyam.
Efectele termice ale reacțiilor chimice.
Algebric căldură sumă th absorbită în timpul reacției și lucrează în funcționare mai perfectă împotriva forțelor externe de presiune (rV) efectul numit-vayutteplovym reacției chimice.
Legile termochimice. Independența căldurii de reacție chimică din calea procesului, atunci când p = const și T = const are în prima jumătate din XIX Creditat-gură. oamenii de știință români G.I.Gessom: Entalpia standard a formării nu depinde de calea pro-percolare, și depinde numai de substanțele naturale și sostoyaniyaiskhodnyh fizice și a produselor de reacție (legea lui Hess).
CATEGORIA termodinamicii chimice teplovyeeffekty studierea reacțiilor chimice nazyvaetsyatermohimiey. În ter-mohimii utilizează o reprezentare simplificată a unui efect de reacție chimică termică îndeplinește condițiile de dex-așteptarea acesteia pe calea procesului. Această căldură qt, furnizat sistemului în timpul reacției (sau a evoluat în reacție) la o temperatură constantă.
În cazul în care căldura este furnizată sistemului (qt> 0), la legarea reacție endotermă, în cazul în care căldura este eliberată în mediul înconjurător (qt <0), реакцию называют экзотер-мической.
Termochimie examinează în primul rând reacția izobarice-izoterme, ca urmare a care se face doar munca, extensii curse V. Efectul termic al acestor reacții qp, T este egal cu sistemul de schimbare H entalpie.
Ecuațiile reacțiilor chimice care indică efectele lor termice nazyvayutsyatermohimicheskimi ecuații. Din cauza stării fizice a materiei depinde de starea sistemului în ansamblu, ecuațiile termochimice folosind indexul alfabetic (k), (g), (p) sau (r) denotă constituit depuneri de substanțe (cristalin, lichid, dizolvat, și gazos diferit). De asemenea, prevede modificarea alotropică a substanței, în cazul în care există mai multe dintre aceste modificări. Dacă substanța Gatnoe sta-stat sau modificarea acestuia în condiții specificate evidente, indici literali pot fi omise. De exemplu, la presiunea atmosferică și temperatura camerei, hidrogen gazos și oxigen (evident) și formarea Xia produsul lor de reacție interacțiune H2O poate fi un (abur) lichide și gazoase. De aceea, ecuația reacției termohimi-ically trebuie specificată starea fizică H2O:
În prezent luate pentru a indica căldura de reacție sub formă de entalpie schimbă H. căldură egal proces izobară-izotermă qp, T. De multe ori, schimbarea entalpie este înregistrată ca H
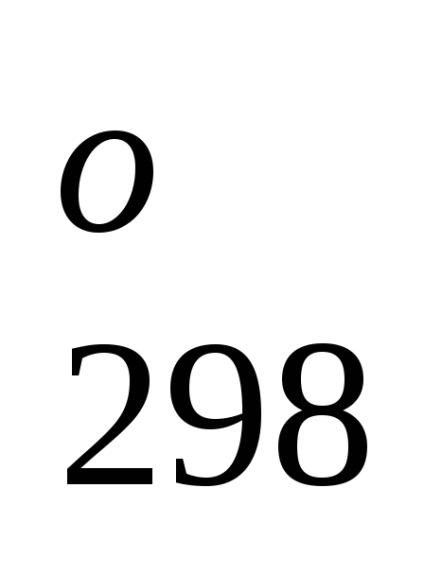
2C6 H6 (g) + 15O2 = 12SO2 6N2 + G (w). H
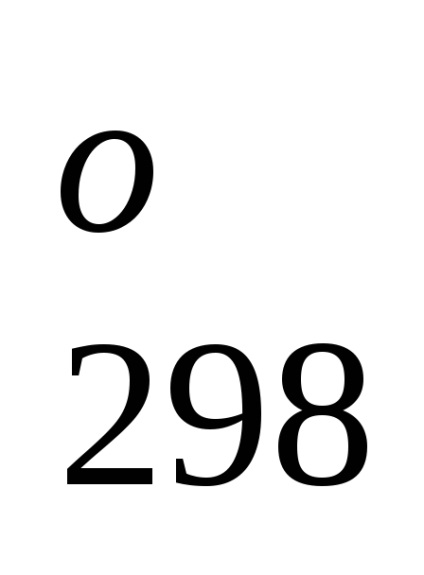
2C (grafit) + C2 H2 = H2. H
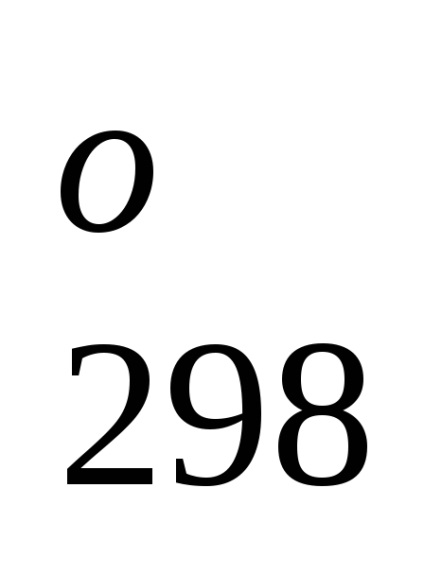
N2 + 3H2 = 2NH3 (g). H
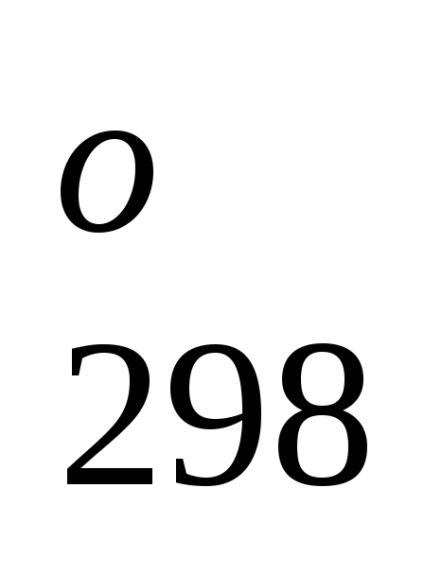
În reacții (a) și (c) entalpia sistemului scade (H
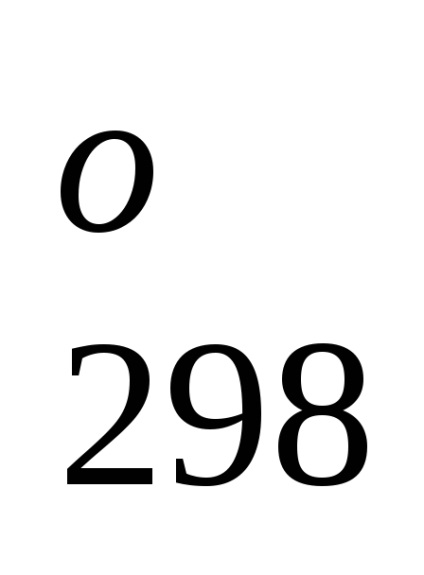
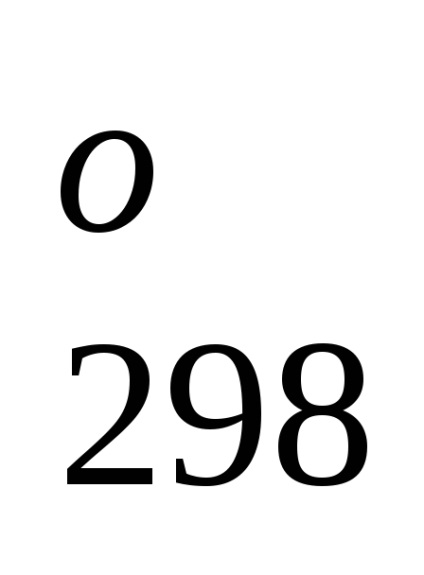
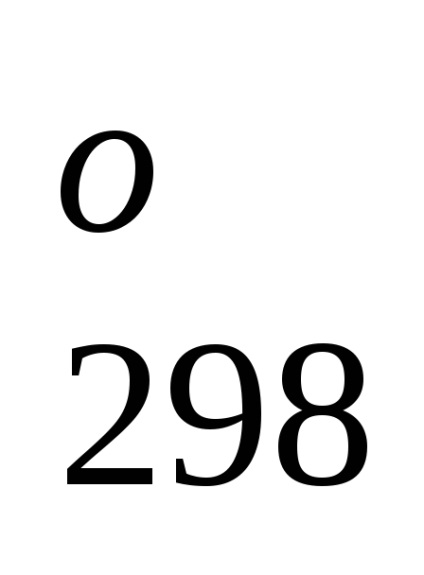
C6 H6 (g) + 7
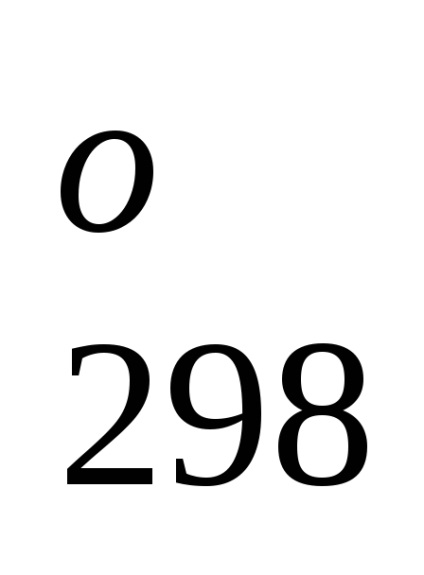
N2 +
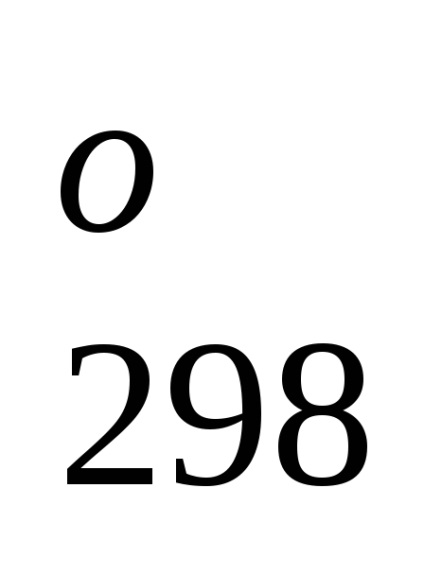
Entalpia formării compușilor chimici.
Entalpie (căldură) obrazovaniyahimicheskogo soedineniyaNTnazyvaetsyaizmenenie entalpie în timpul producerii unui mol de cuplat-TION substanțelor simple stabile la o temperatură dată.
Standartnoyentalpiey (căldură) form-zovaniyahimicheskogo soedineniyaN
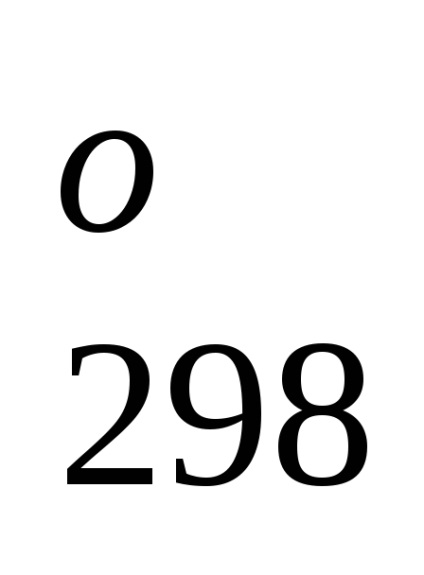
Entalpia standard a formării de substanțe simple, Prien mayutsya ravnyminulyu în cazul în care statele lor agregate și modificarea condițiilor standard de-katsii stabil la. Astfel, de exemplu, egal cu zero căldură standard a formării de brom lichid (mai degrabă decât gazos) și grafit (mai degrabă decât de diamant).
Compus Standard entalpiyaobrazovaniya - masura egotermodinamicheskoy de stabilitate, rezistență, o expresie cantitativă a proprietăților de conexiune de energie.
calcule termochimice. Baza de mai termohimi iCal-decontare este o consecință a legii Hess. reacție chimică termică ef fect este egală cu cantitatea de căldură (entalpie) formarea unui produs de reacție minus suma căldurilor (entalpiile) formând materii prime în ceea ce privește raporturile stoichiometrice în ecuația reacției.
Ecuația (9) permite determinarea căldurii de reacție prin entalpia cunoscute de formare a substanțelor care participă la constituenții de reacție și unul dintre entalpia de formare în cazul în care căldura de reacție cunoscută și entalpia restul de formare.
Entalpia standard de formare este de-energetiche glet proces efect la o procedură constantă tempera-rotund. Folosind datele de referință care se referă la 298 K, este posibil să se calculeze căldura de reacție, care curge-ing la această temperatură. Cu toate acestea, atunci când efectuează calcule termochimice presupunând că de obicei minore EROARE-ku, putem folosi valori standard încălzește obra-mations chiar și atunci când condițiile de proces sunt, difera de standard.
Efectele termice ale modificărilor de fază. Faza-conv scheniya însoțesc adesea reacții chimice. Cu toate acestea, de căldură-tiile efecte ale transformărilor de fază tind să se încălzească mai puține O efecte ale reacțiilor chimice. Mai jos sunt câteva exemple de termochimice transformări de fază ecuații:
H2O (g) H2O (g). H
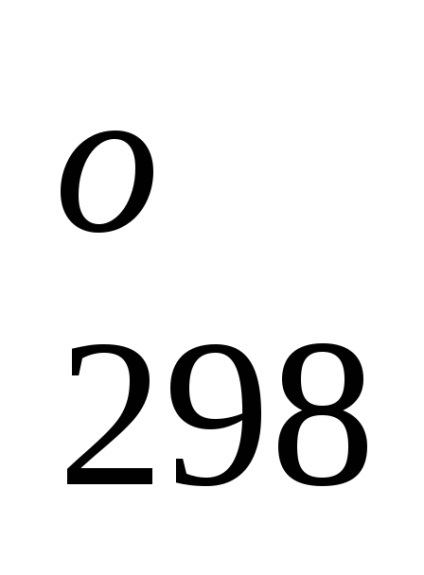
H2O (k) H2O (g). H