Acid sulfuric H2 SO4. spun ei. 98.082 m .; bestsv. Lichid uleios inodor. dibazic foarte puternic la unu la 18 ° C pK a1 - 2,8, K2 1,2 · 10 -2. pKa2 l, 92; obligațiuni în molecula de lungime S = O 0143 nm, S-OH 0.154 nm unghi HOSOH de 104 °, OSO 119 °; fierbe cu descompunere. formând un amestec azeotrop (98,3% SO4 H2 și 1,7% H2O cu p.f. 338,8 ° C .. A se vedea, de asemenea, tabelul 1 ..). Acid sulfuric. care corespunde conținutului de 100% H2 SO4. Are o compoziție (%): H2 SO4 99,5, 0,18, 0,14, H3 O + 0,09, H2 S2 O7 0.04, HS2 O7 0,05. Amestecat cu apă și SO3 în toate rapoartele. În acid sulfuric apos p pax practic complet disociat în H +. și. Formele hidrati H2 SO4 · nh2 O, unde n = 1, 2, 3, 4 și 6.5.
T ra apa de fierbere a p moat crește acid sulfuric cu densitatea și atinge un maxim la un conținut de 98,3% H2 SO4 (Tabel. 2). T ra oleum de fierbere, cu creșterea conținutului de SO3 este redus. Atunci când concentrația de acid sulfuric p moat apos peste presiunea de vapori totală p este coborata-set și când conținutul de 98,3% H2 SO4 atinge un minimum. Odată cu creșterea concentrației de SO3 la presiune totală oleum vaporilor crește deasupra. Presiunea de vapori de acid sulfuric p ramie apă și oleum poate fi calculată prin ur-Niju: lgp (Pa) = A - B / T + 2.126, valorile coeficienților. A și B depind de concentrația acidului sulfuric. Aburul peste amestecul de acid p sulfuric ramie apă este compus din vapori de apă. H2 SO4 și SO3. în care compoziția vaporilor este diferită de compoziția lichidă la toate concentrațiile de acid sulfuric. cu excepția azeotropului corespunzătoare.
Odată cu creșterea-m ry disociere îmbunătățită a H2 SO4 H2O + SO3 - Q, dependența de temperatură set-ur a LNKP echilibru constant = 14,74965 - 6,71464ln (298 / T) - 8 10161 10 4 T 2 -9,643.04 / T-9,4577 · 10 -3 T + 2,19062 x 10 -6 T 2. La presiune normală, gradul de disociere. 10 -5 (373 K), 2,5 (473 K) 27,1 (573 K) 69,1 (673 K). Densitatea de acid sulfuric 100% pot fi identificate prin ur-Niju: d = 1,8517 - - 1,1 · 10 -3 t + 2 · 10 -6 t 2 g / cm 3. Cu creșterea concentrației de acid sulfuric p-moat capacitatea lor de căldură scade și atinge un minim la acid sulfuric 100%. capacitatea termică a oleum, cu o creștere a conținutului crește SO3.
Prin creșterea concentrației și scăderea t-ry l scade de conductivitate termică: l = 0518 + 0,0016t - (0,25 + + t / 1293) · C / 100 unde C este concentrația de acid sulfuric. în%. Max. viscozitate are oleum H2 SO4 · SO3. cu creșterea m-ry h scade. Electrice. rezistenta la acid sulfuric este minimă la concentrații de 30 și 92% H2 SO4 și la o concentrație maximă de 84 și 99,8% H2 SO4. Pentru min oleum. r la o concentrație de 10% SO3. Odată cu creșterea m-ry crește concentrația de acid sulfuric r. Dielectrică. permeabilitate de acid sulfuric 100% 101 (298.15 K), 122 (281,15 K); krioskopich. constanta 6.12, ebulioskopich. constantă de 5,33; coeficienți. difuzia vaporilor de acid sulfuric în schimbările de aer cu t-ry; D = 1,67 · 10 -5 T 3/2 cm2 / s.
Cu ernaya oxidant acid destul de puternic. în special atunci când LOAD.; HI și oxidează parțial HBr pentru GRATUIT. halogeni. -Carbon în CO2. S-a SO2. oxideaza mai mult. metale (Cu, Hg si altele.). Astfel, acidul sulfuric se reduce la SO2. și Naib. Reducători-to puternice S și H2 S. Conc. H2 SO4 H2 parțial restaurat. din cauza care nu poate fi folosit pentru uscarea acestuia. Aliniamente. interacțiune SO4 H2. cu toate metalele. Este în electrochimica. hidrogen la stânga tensiuni rând. cu eliberarea de H2. Oxizii. Insulele pentru dil de comunicare. H2 SO4 sunt mai puțin frecvente. Acidul sulfuric dă două serii de săruri. mediu-de acid sulfați și hydrogensulfates (vezi. Sulfate anorganic) și esterii (vezi. Sulfate organic). Peroxomonosulphuric cunoscut (la-ta Caro) H2 SO5 și peroksodi-sulfuric H2 S2 O8 la-te (vezi. Sulf).
Noțiuni de bază. Materia primă pentru acidul sulfuric sunt: S, metale sulfo-dy. H2 S, gazele de eșapament ale centralelor termice, sulfați Fe, Ca și colab. Bas. sulfuric etapă de producție de acid. 1) de ardere a materiilor prime pentru obținerea SO2; 2) oxidarea SO2 la SO3 (conversie); 3) SO3 absorbție. In Prom-au folosit doua metode STI produce acid sulfuric. mod diferit PIN de oxidare a SO2 utilizând catalizatori solizi (contacte) și oxizi de azot-azot. Pentru contactul cu acid sulfuric la sovr. plante utilizate catalizatori de vanadiu. Pt și oxizi de luat locul Fe. Pure V2 O5 are katalitich slab. activitate. brusc în creștere în prezență. săruri de metale alcaline. în care Naib. K. influențat sare promovează rolul metalelor alcaline datorită formării de pirosulfovanadatov de topire scăzut (3K2 O7 S2 · V2 O5. 2K2 O7 S2 · V2 O5 și K2 S2 O7 · V2 O5. Resp descompunere. La 315-330, 365-380 și 400-405 ° C). Ingredientul activ în condiții de cataliza în stare topită.
oxidarea Schema SO2 la SO3 poate fi reprezentat. mod:
În prima etapă de echilibru este atins. a doua etapă de proces lent și determină viteza.
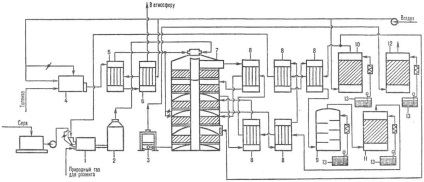
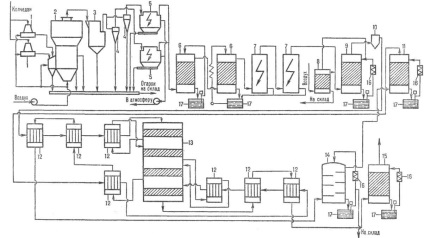
Fig.2. Schema de insule de producție sulfuric la tine Pirite de la: 1 de alimentare placă; 2-cuptor; cazan recuperator 3 termic; 4-cicloane; 5-ESPs; 6-frecat turnuri; 7-umede electrofiltre; turn 8-stripare; turn 9-uscare; 10 bryzgoulovitel; 11, primul absorbant monohidrat; 12 heat-wiki; 13 - Aparate de contact; absorbant 14-Oleum; 15 secunde monohidrat absorbant; 16 frigidere; 17 colecții.
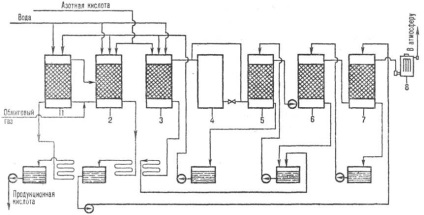
Fig. 3. Schema de insule de producție sulfuric-vă nitrozo metoda NYM: 1 - denitrare. turn; 2, 3, prima și a doua produse. turn; 4-oxid. turn; 5, 6, 7-absorbție. turn; 8 -. ESPs
0,5% este alimentat la a doua etapă de conversie, la cer apare pe unul sau două straturi de catalizator. Preîncălzit al gazului. Schimbătoarelor Grupa 420 ° C din cauza gazelor de căldură. ajungând la a doua etapă a cataliza. După separarea SO3 în a doua treaptă de absorbție, gazul este evacuat în atmosferă.
Gradul de conversie a SO2 la SO3 în metoda de contact la 99,7%, gradul de absorbție al SO3 99,97%. Prod de acid sulfuric se realizează într-o singură etapă de cataliză. gradul de conversie a SO2 la SO3 nu depășește 98,5%. Înainte de a elibera în atmosferă gazul este purificată din restul SO2 (cm. Scrubbing). sovr Performance. Instalații 1500-3100 t / d.
REZUMAT Metoda azotos (Fig. 3) este că gazul de cuptor, după răcire și desprăfuire tratate cu m. Chemat. acid sulfuric nitrosil. într-un sol roi. oxizi de azot. Nitrozo SO2 este absorbit, iar apoi se oxidează: SO2 + N2 + O3 H2O H2 SO4 + NO. Rezultante NO solubilitate proastă. un nitrozo și eliberat din aceasta, și apoi parțial oxidat cu oxigen în fază gazoasă în NO2. Un amestec de NO și NO2 reabsorbit acid sulfuric, etc. Oxizii de azot nu sunt consumate în procesul de azot și a revenit la producție. ciclu, datorită absorbției incomplete a acidului sulfuric acestea sunt realizate parțial departe de gazele de eșapament. Plusuri Metoda nitros: proiectare hardware simplu, costuri mai mici (10-15% mai mic decât contactul), posibilitatea de prelucrare a SO2 100%.
proiectare hardware a procesului turn azotos este simplu: SO2 este transformat în 7-8 turnuri căptușite cu ceramică. dusurile. unul din turnuri (tubulare) este oxida reglabil. volum. Turnurile au colecții la-vă, frigidere, pompe. feed-in in vasele de presiune ale turnurilor. Înainte de ultimele două turnuri set ventilator coada. Pentru a curăța gazul de aerosoli de acid sulfuric este electrostatic. oxizi de azot. necesare pentru procesul se obține din HNO3. Pentru a reduce emisiile de oxizi de azot în atmosferă și o prelucrare a SO2 100% între un produs și zone de absorbție este setat beznitrozny ciclu de procesare a SO2 în combinație cu o soluție apoasă acidă de oxizi de azot trapping adânci. Dezavantajul metodei nitros produse de calitate scăzută: concentrația de acid sulfuric de 75%, prezența oxizilor de azot. Fe și colab., Contaminanții.
Acidul sulfuric a fost determinat colorimetric fotometric și, ca o BaSO4 slam - fototurbidimetricheski și Ku lonometrich. metodă.
Aplicație. Acidul sulfuric este utilizat în producerea-ve leafminer. îngrășăminte. ca electrolit în baterii cu plumb acid. pentru decembrie Miner. k-m, și sărurile acestora. Chem. fibre, coloranți. într-un BB, în ulei, din metal, textile, piele, etc industriile Prom-formatoare de-STI și fum. Este folosit în zonele industriale. org. sinteza în deshidratarea p-tiile (prepararea dietil eter. Esterii) hidratării (etanol din etilenă), sulfonare (Syn. -VA Spălarea și interm. produse în producție-ve coloranți) alkili-TION (prepararea izooctan. polietilen glicol. Capri lactam) și altele. Cel mai mare consumator de acid sulfuric în pro-miner. îngrășăminte. La 1 m de îngrășăminte cu fosfor P2 O5 uzat acid sulfuric 2,2-3,4 m. și m este 1 (NH4) 2 SO4 -0,75 tone de acid sulfuric. Prin urmare, să depună eforturi pentru a construi o instalație de acid sulfuric în combinație cu plante pentru pro-woo miner. îngrășăminte. pro mondial de acid sulfuric în 1987 a ajuns la 152 Mill. T.
Cu acid ernaya și oleum - extrem de agresiv în Insulele, a lovit dyhat. tractului, piele. membranele mucoase, cauzând dificultăți în respirație. tuse, în mod frecvent, laringită, traheită, bronșită și altele asemenea. d. aerosol MPC acid sulfuric în zona de lucru de 1,0 mg / m 3 în atmosfere. aer 0,3 mg / m 3 (max. de locuri de muncă) și 0,1 mg / m3 (valoarea medie). Afectează concentrația acidului sulfuric vaporilor 0,008 mg / l (60 min expunere), mortalul 0,18 mg / l (60 min). Aerosolul Clasa de pericol 2. Acidul sulfuric poate fi format în atmosferă, ca urmare a emisiilor chimice. și metalurgice. în pro ce conțin oxizi S și cad sub formă de ploaie acidă.
Lit. Sernokislotchika Handbook, ed. KM Malina, 2nd ed. M. 1971 Amelin A. Acid sulfuric G. Technology. 2nd ed. M. 1983; Vasilev B. T. Tehnologia Otvagina MI acid sulfuric. M. 1985. Y. Filatov.
