1. Aminoacizii - sunt compuși organici amfoter. Ele conțin în moleculă două grupări funcționale de grupare amino caractere opuse, cu proprietăți de bază, și o grupare carboxil cu proprietăți acide. Aminoacizii reacționează atât cu acizi și baze cu:
Când aminoacidul se dizolvă în apă scindează gruparea carboxil de ioni de hidrogen, care poate adera la gruparea amino. Aceasta formează o sare internă, a cărei moleculă este un ion bipolară, numit un zwitterion:
conversie acid-baza de aminoacizi din diferite medii pot fi descrise prin următoarea schemă:
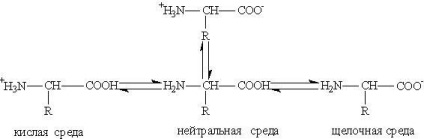
Soluțiile apoase de aminoacizi au un mediu neutru, acide sau alcaline, în funcție de numărul de grupe funcționale. Astfel, acidul glutamic formează o soluție de acid (două grupe -COOH, una -NH2), lizină - alcalină (o grupare -COOH, două -NH2).
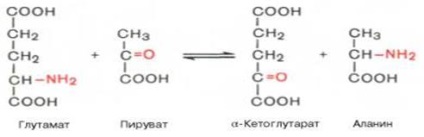
2. transamination - una dintre reacțiile metabolismului aminoacizilor, care este de a transporta o grupare amino (NH2) de aminoacizi în ceto acidă; rezultatul este un acid ceto și un alt aminoacid.
3. dezaminarea - este scindarea grupării amino (-NH2) a moleculei compus organic.
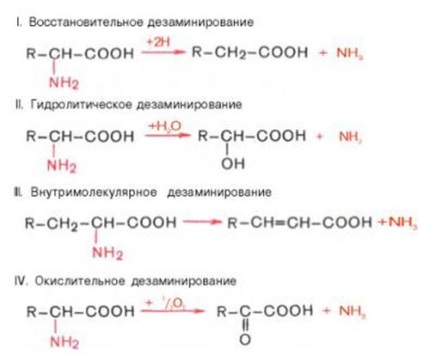
Dezaminare joacă un rol important în procesele metabolice, în particular catabolismului aminoacizi. S-au dovedit existența 4 tipuri de dezaminare de aminoacizi (de scindare a grupărilor amino). Sistemele relevante obținute de enzime care catalizează aceste reacții și produse de reacție identificate. În toate cazurile, gruparea NH2 a aminoacidului este eliberat sub formă de amoniac.
4. Decarboxilarea - este procesul de eliminare a grupării carboxil a aminoacizilor sub formă de CO2 se numește decarboxilare. În ciuda numărului limitat de aminoacizi și derivați ai acestora, suferă o decarboxilare în țesuturi animale produse produse de reacție - amine biogene - au un efect farmacologic puternic asupra multor funcții fiziologice ale oamenilor și animalelor. De exemplu, în țesuturile animale are loc la o viteză mare sub efectul decarboxilarea specific de histidină decarboxilazei.
Histamina exercită un spectru larg de acțiune biologică. Mecanismul de acțiune asupra vaselor de sange este foarte diferit de alte amine biogene, deoarece are un proprietăți vasodilatatoare. O cantitate mare de histamină produs în zonele de inflamatie care are un anumit sens biologic. Cauzarea vasodilatație în inflamația, accelerează astfel histamină aflux de leucocite, promovarea de aparare ale organismului de activare a lui. Mai mult decât atât, histamina este implicat în secreția de acid clorhidric în stomac, care este larg utilizat clinic în studiul activității secretorii a stomacului (testul histamina). Ea are o relație directă cu fenomenele de sensibilizare și desensibilizarea. Cu sensibilitate crescută la histamină la antihistaminice de uz clinica (Sanorin, difenhidramina, etc.) care afectează receptorii vasculare. Histamina este, de asemenea, creditat cu rolul de mediator în durere.
5. Transformări de aminoacizi atunci când este încălzit. # 945; a-aminoacizi și esterii lor mai ușor atunci când formă încălzită peptide ciclice - diketopiperazines:
# 946; -aminoacizi sub încălzire pentru a forma # 945, # 946 Acid-nesaturat cu gruparea amino și separând hidrogen din atomii de carbon adiacenți;
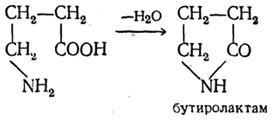
# 947; -, # 948; - și # 949-aminoacizi ca acidul hidroxi corespunzător, apă ușor scindată și ciclizat pentru a forma amidele interne - lactamice:
6. Reacții calitative cu privire la aminoacizi. Calitatea (culoare) reacția aminoacizilor păstrează importanța acestora până în prezent. reacție calitativă generală # 945; aminoacizi - o reacție cu ninhidrină. Toți aminoacizii sunt oxidați ninhidrină pentru a forma produse, vopsite în albastru și violet. Această reacție poate fi utilizată pentru determinarea cantitativă a aminoacizilor spectrofotometric.
Pentru detectarea legăturile peptidice din peptide și proteine este reacția biuret. Pentru a detecta și heterociclic aromatic alfa-aminoacid folosit reacție ksantoproteinovaya. (Din greacă Xantos. - galben). Când este încălzit, aminoacizilor aromatici cu acid azotic concentrat se produce nitrarea a inelului benzenic și compusul format, colorat în galben.