(Din greacă hydor-apă și liza -. Descompunere, degradare), schimbul între p-TION în priza de putere și apă. caracterizează Cantitativ constantă G. G. (constanta de echilibru p-TION G.) G și K grade, care este raportul dintre numărul de molecule sau ioni ai particulelor supuse G. numărul total de particule introduse în p-p. Când și conectate între ele ca o constantă și gradul de ionizare a electrolitului, în care concentrația de p-ra, în mol / l). G. Atunci când se formează săruri și o bază pentru tine. În cele mai multe cazuri, este reversibilă p-TION. Sare hidrolizat în mod ireversibil. cation format o bază foarte slabă, și (sau) la foarte slab anion-te de ex.
Sărurile derivate de cation și anion bază tare a unui puternic la tine (de ex. LiClO4. NaNO3. KC1), în condiții normale și nu hidrolizează la pH-ul lor apos p-moat 7. Sărurile formate cu cationul unei baze puternice și un anion slab la tine ( ex. CH3 COONa), hidrolizat de anion.
Datorită formării OH ionilor p-ry apoasă a unor astfel de săruri sunt alcaline p-TION (pH> 7). Sărurile de polibazici slabe la-t în trepte hidrolizată, în care prima etapă a H. predomină întotdeauna:
Când G. anumitor anioni (WO4 2-. 3- VO4 și colab.) Sunt formate izopolianiony (de ex. W3 O10 2-. V2 O7 4), greutate moleculară și compoziție la ryh dependente condiții p-TION.
Sărurile formate cu cationul unei baze slabe și anion puternic la tine (de ex. A1C13), hidrolizat de cation. P-TION a implicat numai cation, de obicei, o parte a complexului Aqua:
Datorită ionilor hidroniu formării apoase p-Brodarea de astfel de săruri sunt acid p-TION (pH <7). Иногда процесс не заканчивается образованием одноядерного аквагидроксокомплекса, а идет дальше с образованием осадка гидроксо- или оксосоли (редко-гидроксида). При комнатной т-ре в большинстве случаев Г. протекает с образованием остающихся в р-ре многоядерных гидроксокомплексов, состав к-рых, как правило, зависит от условий р-ции. Напр. в водных р-рах, содержащих катионы Fe 3+. Be 2+. Sn 2+. образуются комплексы [Fe2 (OH)2 ] 4+. [Ве э (ОН)3 ] 3 +, [Sn3 (OH)4 ] 2+.
Sărurile formate cu cationul unei baze slabe și un anion slab la tine, de exemplu. Cu (OOSSN 3) 2. hidrolizat prin cation și anion. P PBI astfel de săruri sunt ușor acide sau ușor alcalină p-TION în funcție de faptul dacă ionul este hidrolizat la un grad mai mare.
Când G. halogenurile formate la două și oxigen-H ai halohidric; p-TION în cele mai multe cazuri este ireversibil:
G. Org. compuși utilizate pe scară largă pentru producerea de alcooli, aldehide, cetone, carboxilic k-m derivați ai acestora sau hidrocarburi halogenate, de ex.
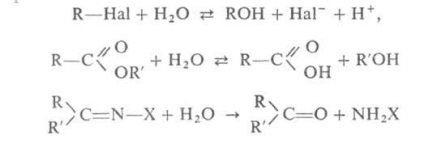
în care X = Ar, OH, NHAr și colab.
G. accelerată în prezența. k-m ioni și baze și metal capabili să lege puternic cu unul dintre produsele și trecerea prin aceasta echilibrul reacției, de ex.
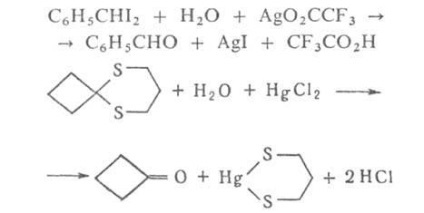
Selectarea condițiilor și catalizatori corespunzători permite să scinda selectiv legături specifice în moleculele care conțin mai multe. grupe capabile să hidrolizeze, de ex.
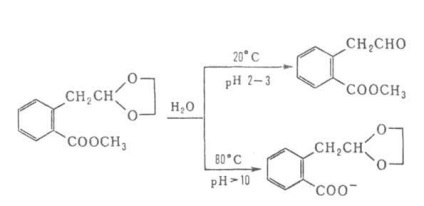
Cunoscut grup extins de enzime (t. Chemat. Hidrolaze) catalizând molecule G. foarte selectiv pentru p. compuși. Procesul se bazeaza pe aceste cele mai multe metode pentru studierea structurii biopolimerilor.
G. Org. Conn. este utilizat pe scară largă pentru a obține glucoza, alcool etilic, acizi carboxilici și altele. grăsimile G. -osnova interm. producătoare de săpunuri și glicerol. Enzymatic G. Org. Conn. utilizate în produsele alimentare, textile, Pharmaceuti. bal-sti. A se vedea. De asemenea, hidroliza producției.
Lit:. BatlerDzh. N. Ionic culoarul de echilibru. din limba engleză. L. 1973; Ingold K. Fundamentele teoretice ale chimiei organice, Acad. din limba engleză. M. 1973; Dnipro A. C Temnikova TI Fundamentele teoretice ale Organic Chemistry, 1979 L. Buhler Pearson D. sinteza organică, trans. din limba engleză. M. 1973. SI Drakin. AV Cheprakov.
Chimice Enciclopedia. - M. sovietic Enciclopedia. Ed. I. L. Knunyantsa. 1988.