Viteza procesului în mai multe etape, care are loc în sistemul de poliesenzime. depinde de concentrația produselor intermediare, precum și de conc. enzima corespunzătoare și cofactorul. Viteza fiecărei etape este determinată de concentrația staționară a acestui produs intermediar, precum și de concentrația enzimei corespunzătoare. Concentrat staționar Toți intermediarii și cofactori determinat raportul vitezei de formare a acestora și a consumului depinde nu numai de activitatea unor sisteme enzimatice, dar și din alte viteze enzimatice p-tiile, la care se folosesc acești compuși.
Cu privire la activitatea enzimei în organism, dar și la viteza enzimatică afectează un număr de factori: afinitate la substrat, constanta lui Michaeles. temperatura, pH-ul mediului, conc. substrat și decomp. cofactori. necesare pentru acțiunea enzimelor, prezența activatorilor și a inhibitorilor.
Coenzimele joacă un rol special în reglarea activității enzimelor.
În absența unei cantități suficiente de coenzime și cofactori în organism, activitatea enzimelor scade.
Activitatea enzimei depinde de concentrația conc. substrat. care participă la secțiunea enzimatică. Când starea p este staționară, substratul este alimentat cu aceeași viteză ca cea folosită în p-tion. Creșterea concentrației substratului determină accelerarea p-tionului la o stare stabilă nouă, unde noua viteză de reacție corespunde unei noi concentrații de substrat.
Sunt cunoscute sisteme de polinime. în care rata reacțiilor enzimatice este reglată de concentrația produsului final în lanțul de transformări succesive. Baza acestui tip de reglementare este inhibare (sau activare) 1 etapele-ing enzimei în produșii finali de biosinteză numite inhibare p-TION (sau activarea) a tipului de feedback. Inhibitorii și activatorii care acționează pe principiul feedback-ului se numesc efectoare.
20 clasificarea reacțiilor enzimatice în ordine. Chimia de r-tion, care apare în sistemele biologice, este împărțită în funcție de moleculă și conform ordinii generale. Mol-st este determinat de numărul de particule care participă la transformările chimice. Reacțiile în acțiunile elementare care implică 1, 2 sau 3 particule se numesc p-tiuni mono-, bi- și tri-moleculare. Probabilitatea coliziunii a mai mult de 3 particule este mică și p-tionul continuă în mai multe etape elementare. Sistemele bio sunt caracterizate de reacții mono- și bimolare. O caracteristică importantă a reacțiilor este viteza. Viteza procesului chimic este creșterea sau scăderea în timp a substanței C. Numărul de coliziuni în condiții externe date este o funcție a concentrației substanțelor care reacționează. Condiții externe - temperatură, presiune, mediu. Ca rezultat, porțiunea p-TION a moleculelor inițiale consumate în formarea produselor de p-TION și în C ref-o scădere, rata de p-TION scade. Acesta este motivul pentru care p-tiunile mono- și bimoleculare vin cu o viteză descendentă în continuă scădere.
Dacă rata p-tionului este independentă de reactivii C, atunci se numește reacție de ordin zero. Lăsați-un A-turn să devină un B cu o viteză independentă de C a substanței A. Un exemplu poate fi p-tionul enzimatic, trecând în condiții de substrat în exces. Ecuația cinetică a acestui proces are forma:
Soluția acestei ecuații este funcțiile timpului liniar:
b = k0 t + C2. unde C este constanta de integrare
-Ko, pentru că concentrația scade
Ko t, t. concentrația este în creștere
Pentru ca aceste ecuații să fie aplicabile în practică, este necesar să se găsească C în condițiile limită t = 0, a = a0, b = 0.
Reacția de prim ordin este un proces a cărui rată depinde de una dintre concentrații (de la C la una dintre substanțe). Fie ca substanța A să fie convertită la substanța B cu viteza K1.
Soluția acestei ecuații este yavl. exp:
la începutul condiției t = 0, a = a0, b = 0, C1 = a0. De la B la B ajungem din legea conservării materiei a + b = a0, b = a0-a. Desene grafice:
Un P-tion al doilea ordin este un proces a cărui viteză depinde de concentrația reacțiilor in-in. Să presupunem că A și B primesc o valoare C cu viteza K2. Denumim prin x numărul fiecăruia dintre s, până la momentul t. Pentru fiecare dintre aceste un x va fi în aceeași (ca și în interacțiunea insulelor în raport 1: 1), ei formează .Kin ur: dx \ dt = k2 (a0 - x) (b0 - x) în din primul dintre reactivi, p-tiunea celei de-a doua raze n va curge prin schema ordinului p de ordinul întâi, C, de exemplu, in-Va va fi schimbat.
O caracteristică a cineticii proceselor biologice este prezența în sistem a agenților capabili să afecteze rata p-tionului. Acestea includ enzimele care catalizează biochimia. transformare. Cinetica enzimatică studiază legile influenței naturii chimice a substanțelor și a condițiilor de reacție. interacțiunile lor cu privire la rata p-tiunilor. La viteza chimică. P. afectează următorii factori:
-t 0. v rata de p-tions crește odată cu creșterea temperaturii până la o anumită limită.
-Deoarece enzimele conțin coenzime și metale, rata de p depinde de concentrația de coenzime și metale.
-prezență în rr-r. activatori și inhibitori de enzime.
Rata de p-tiuni se supune legii, conform căreia reacția se desfășoară mai repede, cu atât mai mult conc. in-in. Să presupunem că avem o p-ation A + B C + D
v1 este proporțional cu produsul concentrațiilor A și B ale concentrațiilor v-1 ale lui C și D. k1 este rata constantă. aceasta este viteza normalizată, adică este egal cu rata de p-tion la o concentrație de reactanți = 1.
Dacă există echilibru chimic. și anume v1 = v-1 atunci putem scrie:
keq - constanta de echilibru -a este egală cu produsul concentrației în afara echilibrului la starea de echilibru.
La începutul secolului al XX-lea sa stabilit că, dacă se menține concentrația F. t-const, iar concentrația inițială a substratului variază foarte mult. atunci schimbarea vitezei inițiale a p-tionului este exprimată printr-o linie dreaptă cu saturație:
Această curbă arată. că dependența este inițial aproape de liniar (la concentrații scăzute de substrat) și apoi atinge valoarea maximă. p-TION primei ordine la concentrații scăzute ale substratului merge în ordinul zero p-TION (t.e.pri rate care p-TION este independentă de conc. reacționează-h-o), viteza de p-TION este proporțională cu concentrația enzimei. Mat. Cel de-al cincilea model de cataliză a fost dezvoltat de Michaels și Menten în 1913. ei au propus o secvență de procese în două etape:
E + S ES E + P. unde P este produsul, substratul S, enzima E.
la prima etapă reversibilă, se formează un complex enzimă-substrat, care apoi se rupe ireversibil într-un produs final și eliberează molecula F pentru a participa la următorul ciclu. Schimbarea cinetică a concentrației substanțelor care reacționează ia forma: ds \ dt = -k2 es + k -1 (es)
dp \ dt = k1 (es) = - ds \ dt
pentru a rezolva acest sistem de ecuații. se impune o condiție suplimentară de închidere a sistemului. p rămâne în reacție. Numărul total al moleculelor F este, de asemenea, constant.
folosind aceste date, vom scrie ecuațiile c după cum urmează:
impunem condițiile de graniță: t = 0, t (es)
aceasta înseamnă că curba cinetică a complexului (lor) va conține un maxim. Derivatul în regiunea de max. des \ dt = 0 este condiția de staționare pentru procesul E + S Es E + P
soluția ecuației pentru des \ dt = 0 ne dă:
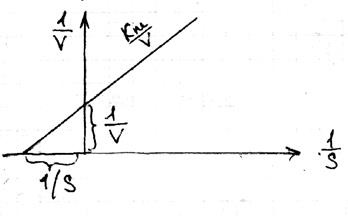
Ecuația Lainuver-Burke
Prin dimensiune și semnificație fizică, Km este concentrația substratului. la care jumătate din molecula substratului, în care jumătate din moleculele enzimei este într-o stare complexă. Staționarea procesului enzimatic are loc acolo unde concurența substratului este mai mare decât concurența enzimei, adică există un flux continuu de substrat și ieșire de produse. Pentru viteza de p-tion
Pentru o concentrație foarte mare S, Vmax Vmax S \ (k m + S)
Lynuver și Burke au propus să se mute într-o formă liniară. unde relația inversă este prezentată: 1 \ v = 1 \ vmax (km \ S +1) este ecuația Lynuwer-Burke.
Acest lucru este cel mai convenabil pentru testare:
O caracteristică a cineticii proceselor biologice este prezența în sistem a agenților capabili să afecteze rata p-tionului. Acestea includ enzimele care catalizează biochimia. transformare. Cinetica enzimatică studiază legile influenței naturii chimice a substanțelor și a condițiilor de reacție. interactiunile lor asupra ratei de p-tiuni. La viteza chimică. P. afectează următorii factori:
-t 0. v rata de p-tions crește odată cu creșterea temperaturii până la o anumită limită.
-Deoarece enzimele conțin coenzime și metale, rata de p depinde de concentrația de coenzime și metale.
-prezență în rr-r. activatori și inhibitori de enzime.
Rata de p-tiuni se supune legii, conform căreia reacția se desfășoară mai repede, cu atât mai mult conc. in-in. Să presupunem că avem o p-ation A + B C + D
v1 este proporțională cu produsul concentrațiilor A și B ale concentrațiilor v-1 ale lui C și D. k1 este rata constantă. aceasta este viteza normalizată, adică este egal cu rata de p-tion la o concentrație de reactanți = 1.
Dacă există echilibru chimic. și anume v1 = v-1 atunci putem scrie:
keq - constanta de echilibru -a este egală cu produsul concentrației în afara echilibrului la starea de echilibru.
25 Starea staționară și clasificarea sistemelor de polienime.
Întregul ciclu de schimb este un sistem deschis, la pisică. Tot timpul vin din lumea exterioară. Ele suferă transformări în organism și sunt eliminate ca produse finale. Reglarea proceselor biochimice din celulă se realizează cu ajutorul direct și feedback-ului. Scopul reglementării este de a menține concentrațiile diferitelor celule din celulă la nivel. cat. Aceasta este determinată de nevoile celulei. Majoritatea reacțiilor biochimice sunt catalizate de enzime, astfel încât mecanismul de reglare constă în schimbarea activității și concentrației enzimei. Un sistem polenzimatic este numit un sistem de enzime interdependente care catalizează diferitele etape ale proceselor metabolice. Dacă se află în concentrația de poliestimă c-me a tuturor componentelor. și anume, enzima, substratul și produsele p-tionului, cu trecerea timpului rămân const. atunci este într-o stare staționară. Spre deosebire de starea de echilibru staționar de faptul că, în fix starea h \ s c-lea a avut loc flux staționar constant în insule și o stare x-Xia flux energetic const. Compoziția sistemelor de policenzime poate fi omogenă și eterogenă. Cel mai important proces din poliesenzime poate fi clasificat în următoarele tipuri:
Separat, putem izola c-ma cu auto-reglare (c-noi cu feedback)
Procesele radicalilor liberi în sistemele biologice
în procesele biologice toate tipurile de plastic sintetic IE de energie transportate de discrete, în care joacă un rol important transfer de un electron de energie și formarea de particule paramagnetice cu un singur sau e -MI nepereche (radicali liberi). Radicalii liberi sunt foarte activi. Între numărul de e-concept nepereche este nou și valență liberă a atomului este o identitate directă. In-va cu e-minelor nepermanente sunt împărțite în 2 grame:
-in-va, în care electronii neparticipați sunt conectați fie la întreaga moleculă, fie la cea mai mare parte a acesteia. Acești electroni nelegați se deplasează de-a lungul orbitalelor moleculare puternic delocalizate și determină o activitate înaltă a grupurilor externe de atomi.
-in-va, în care electronii nepereche se leagă la o moleculă cu un atom. Ei nu se mișcă prin orbitele moleculare care acoperă toți atomii. Astfel de legături nereparate. cu atomii din grupul de tranziție (Fe, Co, Ni) / acești electroni nepereche sunt de interes pentru studierea mecanismelor semiconductoare.
Aceasta este ceea ce determină
-monoradicii cu un E1 (OH-) nepereche
-biradicals cu 2 nepereche Elmi.