Modalități de transport a proteinelor în celulă
Modalități de transport într-o cușcă
Sinteza proteinelor începe întotdeauna în citoplasmă. Sfârșitul sintezei apare în citoplasmă sau pe un reticul endoplasmic dur (SHER).
Este posibilă alocarea condiționată a două moduri de transport al proteinelor într-o celulă:
1. Din citoplasmă până la unele organele (nucleu, plastide, mitocondri)
2. O modalitate foarte bună de a transportului vezicular de la RER prin aparatul Golgi (AG) la alte organite (lizozomi, peroxizomi) și prin veziculele secretorii la mediul extracelular. Deoarece sinteza tuturor proteinelor începe în citoplasmă și localizarea finală a fiecărei proteine poate fi diferită în cadrul polipeptidei, există un sistem de semnal care determină calea sa de transport. semnalul primar determină calea de citoplasmă (în RER, un nucleu, mitocondrii sau plastidă) definește în continuare direcția semnalului secundar, de exemplu, membrana mitocondrială exterioară sau interioară sau o matrice; lizozom, peroxizom sau granule secretoare.
Semnele de semnal ale proteinelor
Secvențele de semnal au o lungime de 3-80 aminoacizi recunoscute de receptori specifici pe membranele diferitelor compartimente ale compartimentelor.
Secvența de semnal ER este o regiune hidrofobă de 5-15 aminoacizi la capătul N-terminal al polipeptidei.
Semnalul proteinelor mitocondriale este de 20-80 de aminoacizi constând dintr-o spirală și extremitățile proeminente - (+) - încărcate și hidrofobe. 5 (+) - aminoacizi încărcați pentru transportul către nucleu. Proteinele peroxizomale au o secvență la capătul C-terminal al Ser-Lys-Leu-COOH.
Există o clasă de secvențe de semnal care nu permit proteinei care a ajuns la o anumită localizare să fie transportată în continuare. De exemplu, motivul Lys-Asp-Glu-Leu-COOH (KDEL) nu permite proteinelor să părăsească reticulul endoplasmatic.
Una dintre funcțiile ER netedă este retenția de calciu gata de eliberare în citozol în timp ce stimulează celula. Calreticulina este o proteină care reține ionii de calciu. Primii 17 aminoacizi includ 14 secvențe semnal hidrofobe (albastre) pentru penetrarea în ER de la citozol. Ultimii patru aminoacizi ai KDEL rețin proteina în ER.
(NH2) MLL S VPLLL G LL G LAVA E PAV Y F K EQ FL DGDG W TSR WI ESKHKSD F GK FVL SSGK F
YGDEEKDKG L QTSQD A R F Y A S F E PF SNKGQT LVV Q F T V KHEQN I DCGGGY V K LFP
NS L DQTD M HGDSEYN FMI G P D I CG P GTKK V H VIF NYKGKN VLI NKD I RCKDDE F TH L YT LIV R P
DNTYE V K I DNSQ V ESGS L EDD W D FLPP KK I KD P D A SK P ED W DER A K I DD P TDSK P
ED W DK P EH IP D P D A KK P ED ED M E DGE W E PPVI QN P EYKGE W K P RQ I
DN P DYKGT WI H P E I P A N I P R A P D P S I Y YDN F
G VL G L D LW Q V KSGT IF DN FLI TNDE A YE EE F GNET W G V TK AA EKQ M KDKQDEEQR L
KEEEEDKKRKEEEE A EDKEDDEDKEDEDEDEEDKEEDED VP GQ A KDE L (COOH)
Transportul către miez
Transportul în mitocondrii și plastide
Mitochondria și plastidele au ADN propriu și sintetizează în mod independent unele proteine. Cu toate acestea, multe dintre proteinele majore ale mitocondriilor și plastidelor sunt sintetizate în citozol.
Proteinele care pătrund în mitocondrii trebuie să poarte un semnal care determină localizarea - membrana internă sau externă sau matricea.
Proteinele desemnate pentru matrice poartă un semnal la capătul N-terminal, care este recunoscut de receptorii de pe membrana exterioară. Receptorul este legat de complexul de transfer de proteine, care desfasoara proteina si o transporta prin membrana. După transferul de proteine, secvența de semnal este întreruptă și proteina este pliată din nou.
Proteinele chaperone se leagă de proteina recent sintetizată care împiedică plierea acesteia.
Chaperoninele se leagă de proteine după ce sunt transportate la locul de livrare și promovează plierea adecvată.
Ca răspuns la diferite efecte stresante (de exemplu, o creștere a temperaturii), chaperonele numite hsp (proteine de șoc termic) care sintetizează proteinele celulare sunt sintetizate în celulă. Hsp se găsesc în toate compartimentele celulare ale eucariotelor și bacteriilor.
Transport vezicular
De la o organelle la alta, mișcarea are loc în vezicul sau pe suprafața sa sub formă de proteine integrale.
Compartimentul donator - organelle din care membrana se separă în vezicul, compartimentul acceptor - ia vezicula.
constituție secretă - apare în mod constant și nu depinde de semnalele externe.
secreția secretă - sub PM apare acumularea de vezicule care se îmbină cu PM în prezența semnalelor externe - hormoni, nervi - și creșterea sfârșitului. Ca2 + până la 1 km
transport retrograd - returnarea proteinelor receptorilor și a lipidelor de la AH la Er - reaprovizionarea membranei ER.
Transport anterograd - proteine solubile de marfă se deplasează prin secreția organelle sau veziculelor secretorie cale veziculă ER → cis-Golgi vezicula trans-Golgi ?????
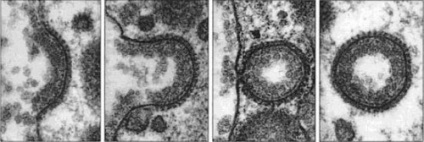
Okaylennye vezicule - acoperite cu proteine, pisica recunoaște și concentrează specifice. proteinele m-le și bulele m-a separate, formează o rețea și formează vezicula: clathrin, COPI, COPII:
Clathrin Vesicles -
0,1mkm, transportul AG și PM, clathrin - Type3, trei mari și trei subunități mici care formează triskeleton - colectarea pe suprafața m-HN din citoplasmă la penta- și hexagoanele, pisica formează în mod spontan o sferă. Adaptin - se leagă la-clathrin clorhidric m și prinde diferite proteine-transm LARG incluzând receptorii de transport, cat. capturarea proteinelor de marfă r -imi, pisica ajunge în vezicul. Are cel puțin 4 tipuri de adaptin
Dynamin - GTP-ază, p - proteină citoplasmatică solubilă, formează un inel pentru separarea veziculelor filmate clathrin - ajustează numărul de clathrin clivat cu m clorhidric compus de asociat vezicula alte proteine ajuta vypuchit m-godeuri și proteine modificatori lipidelor modifica local lipidelor compoziția găurii pentru flambaj
După separarea veziculelor de la mt-clathrin și adipin, chaperonele - ATP-urile din familia hsp70 - sunt separate. Auxilin - atașat la vezicula și activează ATP-ase. Deoarece marginea veziculelor de formare este n. mai mult decât janta separate - există un mecanism de stabilizare. Carcasa clathrin oferă o forță semnificativă pentru îndoirea mn, veziculele din compartimentele intracelulare se formează pe m-nu expulzat deja
COP-I - transportul de la AH și ER, 8 subunități, factorul GTP-ribosilarea ADP-ARF-transport
COP-II - transport de la AH și ER, 5 subunități
Vesiculele mb nu sunt doar sferice, se formează adesea vezicule tubulare în care un raport S / V ridicat
Formarea clalitinei și a veziculelor COP este reglată de proteinele care leagă GTP care pot fi găsite în starea GTP activă și inactivă
Două clase de proteine face schimb PIB-GTP: schimb GEF-guanină-nucleotidă-factor activeaza proteine care înlocuiesc GDF GTF, proteina GAP- activarea GTP-ază - inactiveaza proteine de legare GTP prin modificarea GTP PIB ??.
GTPaza necesară pentru asamblarea veziculelor marginale înainte de colectarea veziculelor: proteine monomerice de legare la GTP (GTPază):
ARF-proteinele sunt necesare pentru ansamblurile de clathrin și COP la locațiile miniere AH. Proteina Sar1, necesară pentru asamblarea COPII pe ER m-nu
trimeric (proteine G).
GTP-ază găsit în citosol într-o stare inactivă înainte de asamblare GEF este construit în M-ER bine și se leagă citosolice Sari, pisica swap-GDF? GTP. În starea GTP, SarI este construit cu restul de reziduu uleios din unitatea ER. Asociază proteinele obi și inițiază dezvoltarea veziculei. GTP-ază prins în m-well activa fosfolipaza D, cat convertește fosfolipide fosfotidnuyu la unul care îmbunătățește învelișul proteic de legare. Împreună, interacțiunile proteine-proteine și proteine-lipide se înclină bine
SNARE - proteine - sunt responsabile pentru fuzionarea donor și acceptor m-n, 20, fiecare pentru pansamente cu specificitate whith m-HN, proteine transmembranare pe un vezicule dressing minut - v-SNAr, pentru dressing-donator ti - t-SNAr. Interactiunea v- și t-SNAr sfori etc. altele în trans-SNAr-complex oferind md fuziune. SNF-proteina distruge trans-SNAr complexele - chaperone citosolic ATP-azei folosește adaptarea proteine pentru a se lega la complexul SNAr
Rab-proteine - monomeric GTP-ază, 30, fiecare organelle are cel puțin un Rab pe m-nu din citoplasmă este controlată de andocare de vezicule și legarea v-SNAr-s și t-SNAr-uri necesare pentru md fuziune. PIB-stat nu este activ, încearcă în citosol, în stare GTP activă și trecerea la pansamente Th organite m-HN sau vezicule. In stare activa Rap se leagă la M-clorhidric ancora lipidică și se colectează alte proteine implicate în fuziune m-n
Rab-GDP inactiv este asociat cu inhibitorul de disociere GDI-GDP. Rab PIB asociat cu GEF, guanina factor de schimbare a nucleotidelor asociat cu un compartiment donor m termen - modificarea PIB pentru GTP. Rab-GTP se leaga de-m clorhidric vezicule care formează și asociate v-SNARE, care sunt compuse dintr-o veziculă și organelle transportat se lega la Rab efectori și t-laț, asociat cu compartimentul acceptor m clorhidric și asigură fuziune m-n
proteină organelară
Rab1 ER și AG
Rab2 cis-AG
Rapeluri sinaptice Rab3A, granule secrete
Ultimele endosomi Rab4
Rab5A PM, vezicule clatinice
RaboC endosomes devreme
Rab6 intermediar și trans-AG
Ultimele endozomi Rab7
Rabulele vezicule secretoare Rab8 (bazolaterale)
Endosomii târzii Rab9, trans-AG
Îmbinarea survine nu numai cu transportul vezicular: fuziunea spermei cu oul, fuziunea mioblastelor în timpul dezvoltării celulei musculare.