Sunt utilizate diferite metode pentru protejarea metalelor de coroziune, care pot fi împărțite condiționat în următoarele direcții principale: aliaj de metale; acoperiri protectoare (metalice, nemetalice); protecția electrochimică; schimbarea proprietăților mediului coroziv; proiectarea rațională a produselor.
Aliajul metalelor. Aceasta este o metodă eficientă de creștere a rezistenței la coroziune a metalelor. Atunci când aliajul sau aliajele metalice (crom, nichel, molibden, etc.) sunt aliate, se introduc în compoziția aliajului sau metalului, determinând pasivitatea metalului. Pasivizarea este procesul de tranziție a unui metal sau a aliajului într-o stare a rezistenței sale la coroziune crescută cauzată de inhibarea procesului anodic. Starea pasivă a metalului se explică prin formarea pe suprafața sa a unui film de oxid perfect structurat (filmul de oxid are proprietăți protectoare, cu condiția ca laturile cristaline ale metalului și oxidul rezultat să fie maxim similare).
S-a găsit o aplicație largă pentru aliaj pentru protecția împotriva coroziunii cu gaz. Fierul, aluminiul, cuprul, magneziul, zincul și, de asemenea, aliajele pe care se bazează sunt supuse aliajelor. Ca urmare, se obțin aliaje cu rezistență la coroziune mai mare decât metalele în sine. Aceste aliaje au rezistență la căldură și rezistență la căldură.
Rezistența la căldură - rezistență la coroziunea gazului la temperaturi ridicate. Rezistența la căldură - proprietățile materialului structural pentru menținerea unei rezistențe mecanice ridicate, cu o creștere semnificativă a temperaturii. Rezistența la căldură este de obicei asigurată prin aliajele de metale și aliaje, de exemplu oțelul cu crom, aluminiu și siliciu. Aceste elemente sunt oxidate la temperaturi mai ridicate mai energic decât fierul și formează pelicule de protecție dense de oxizi, de exemplu, Al2O3 și Cr2O3.
Dopajul este de asemenea utilizat pentru a reduce viteza de coroziune electrochimică, în special coroziunea cu evoluția hidrogenului. Oțelurile rezistente la coroziune, de exemplu, includ oțelurile inoxidabile, în care cromul, nichelul și alte metale servesc drept componente de aliere.
Acoperire de protecție. Straturile create artificial pe suprafața produselor metalice pentru a-și proteja coroziunea se numesc acoperiri protectoare. Aplicarea acoperirilor protectoare este metoda cea mai comună de combatere a coroziunii. Acoperirile protectoare nu numai că protejează produsele împotriva coroziunii, ci și conferă suprafețelor o serie de proprietăți fizice și chimice valoroase (rezistență la uzură, conductivitate electrică etc.). Ele sunt împărțite în metal și nemetalice. Cerințele generale pentru toate tipurile de acoperiri protectoare sunt aderența ridicată, continuitatea și rezistența într-un mediu agresiv.
Acoperiri metalice. Acoperirile metalice ocupă o poziție specială, deoarece acțiunea lor este de natură dublă. Până când integritatea stratului de acoperire nu este rupt, efectul său de protecție este redus la izolarea suprafeței metalului protejat din mediul înconjurător. Aceasta nu diferă de acțiunea oricărui strat mecanic de protecție (culoare, film de oxid, etc.). Acoperirile metalice trebuie să fie impermeabile pentru agenții corozivi.
Dacă stratul (sau prezența porilor) este deteriorat, se formează o celulă galvanică. Natura distrugerii corozive a metalului de bază este determinată de caracteristicile electrochimice ale ambelor metale. Acoperirile anticorozive de protecție pot fi catodice și anodice. Acoperirile cu catozi includ acoperiri ale căror potențiale într-un mediu dat sunt mai pozitive decât potențialul metalelor de bază. Acoperirile cu anod au cel mai mare potențial negativ decât potențialul de metal de bază.
De exemplu, în ceea ce privește fierul, acoperirea cu nichel este catodică, iar stratul de zinc este anodic (Figura 2).
Dacă stratul de nichel este deteriorat (figura 2, a), oxidarea fierului are loc la secțiunile anodice ca urmare a apariției celulelor galvanice microcorozive. La locurile catodice - refacerea hidrogenului. Prin urmare, acoperirile catodice pot proteja metalul de coroziune numai în absența porilor și deteriorarea stratului de acoperire.
Deteriorarea locală a stratului de zinc protector duce la distrugerea acestuia, în timp ce suprafața fierului este protejată de coroziune. La siturile anodice are loc procesul de oxidare a zincului. La siturile catodului - refacerea hidrogenului (Figura 2, b).
Potențialele de electrozi ale metalelor depind de compoziția soluțiilor, prin urmare, atunci când compoziția soluției este schimbată, natura stratului se poate schimba.
Pentru acoperiri metalice sunt diferite moduri: electrochimice (acoperire galvanica), scufundare în metalul topit (galvanizare la cald, staniu); metalizare (desen din metalul topit pe suprafața care urmează să fie protejate prin intermediul unor jeturi de aer comprimat), chimice (prepararea acoperirilor metalice folosind reductori de exemplu, hidrazină).
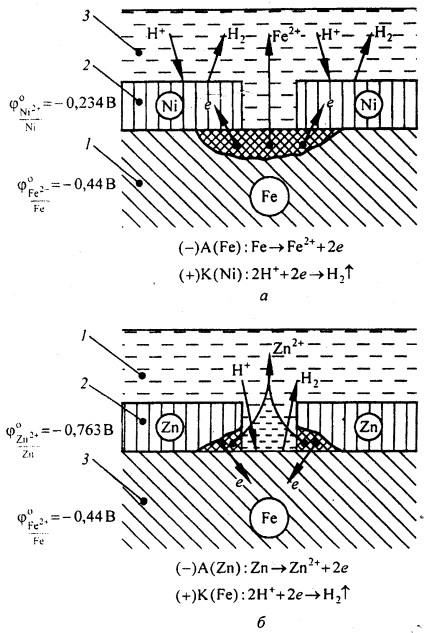
Fig. 2. Coroziunea fierului într-o soluție acidă cu acoperiri catodice (a) și anodice (b): 1 - metale comune; 2 - acoperire; 3 - soluție electrolitică.
Materiale pentru acoperiri metalice pot fi ambele metale pure (zinc, cadmiu, aluminiu, nichel, cupru, crom, argint, etc.) și aliajele lor (bronz, alama, etc.).
Straturi de protecție nemetalice. Ele pot fi atât anorganice, cât și organice. Efectul protector al acestor acoperiri este redus în principal la izolarea metalului din mediul înconjurător.
Ca și acoperiri anorganice se utilizează emailuri anorganice, oxizi metalici, compuși de crom, fosfor etc. Organice includ vopselele de vopsea, acoperirile cu rășini, materialele plastice, peliculele polimerice, cauciucul.
Emailele anorganice în compoziția lor sunt silicați, adică compuși de siliciu. Principalele dezavantaje ale acestor acoperiri includ fragilitatea și fisurarea în timpul șocurilor mecanice și mecanice.
Vopsirea este cea mai obișnuită. Vopseaua trebuie să fie solidă, rezistentă la gaz și impermeabil, rezistentă la chimic, elastică, are o aderență ridicată la material, rezistență mecanică și duritate.
Metodele chimice sunt foarte diverse. Acestea includ, de exemplu, tratarea suprafeței unui metal cu substanțe care reacționează chimic cu acesta și formează un compus chimic stabil pe suprafața sa, la formarea căruia participă și metalul protejat în sine. Oxidarea este o astfel de metodă. fosfatare, sulfurare etc.
Oxidarea - procesul de formare a filmelor de oxid pe suprafața produselor metalice.
Metoda moderna de oxidare este tratamentul chimic si electrochimic al pieselor in solutii alcaline.
Pentru fier și aliajele sale, oxidarea alcalină este cel mai des utilizată într-o soluție care conține NaOH, NaNO3. NaNO2 la o temperatură de 135-140 ° C. Oxidarea metalelor feroase se numește negru.
La locurile anodice, are loc procesul de oxidare:
La locurile catodice procesul de restaurare are loc:
2 H2O + 02 + 4

Pe suprafața metalică se formează Fe (OH) 2 ca rezultat al lucrării elementelor micro-galvanice. care este apoi oxidat la Fe3O4. Filmul de oxid pe oțeluri cu conținut redus de carbon are o culoare neagră neagră, iar pe oțel de înaltă carbon - negru, cu o nuanță cenușie.
Fe2 + + 2OH -
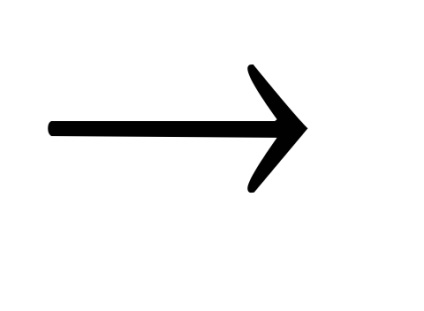
12 Fe (OH) 2 + NaN03
Proprietățile anticorozive ale filmului cu oxid de suprafață sunt scăzute, astfel încât domeniul de aplicare al acestei metode este limitat. Scopul principal este finisajele decorative. Arderea este utilizată atunci când este necesar să se păstreze dimensiunile originale, deoarece filmul de oxid este de numai 1,0 - 1,5 microni.
Fosfatarea este o metodă de obținere a peliculelor de fosfat pe produse din metale neferoase și feroase. Pentru fosfatare, produsul metalic este scufundat în soluții de acid fosforic și sărurile sale acide (H3P04 + Mn (H2PO4) 2) la o temperatură de 96-98 ° C.
Pe suprafața metalică, ca urmare a filmului fosfat mikrogalvanicheskih format elemente care au o compoziție chimică complicată și conține o două- hidrat greu solubil și trei fosfați substituiți de fier și mangan: MnHPO4. Mn3 (PO4) 2. FeHPO4, Fe3 (PO4) 2, nnH20.
La locurile anodice, are loc procesul de oxidare:
La siturile catodice, are loc procesul de reducere a hidrogenului:
2H +2


Interacțiunea dintre ionii Fe 2+ și anionii de acid ortofosforic și sărurile sale acide produce folii fosfatice:
Fe 2+ + H2 PO-4
3Fe 2+ + 2 PO4 3-
Filmul fosfat rezultat este legat chimic de metal și constă din cristale intergrupte separate de pori de dimensiuni ultramicroscopice. Filmele fosfatice au o adeziune bună, au o suprafață grosieră dezvoltată. Ele sunt un bun primer pentru aplicarea de unsori de vopsea și de impregnare. Acoperirile cu fosfat sunt folosite în principal pentru a proteja metalele împotriva coroziunii în spații închise și, de asemenea, ca o metodă de preparare a suprafeței pentru vopsirea ulterioară sau lacuit. Dezavantajul peliculelor fosfatice este forța scăzută și elasticitatea, fragilitatea ridicată.
Anodizarea este procesul de formare a filmelor de oxid pe suprafața unui metal și, în primul rând, a aluminiului. În condiții normale, pe suprafața de aluminiu există o peliculă subțire de oxid de oxizi de Al2O3 sau Al2O3 · nH2O, care nu îl poate proteja de coroziune. Sub influența mediului, aluminiu este acoperit cu un strat de produse de coroziune. Procesul de formare artificială a filmelor de oxid poate fi realizat prin metode chimice și electrochimice. În oxidarea electrochimică a aluminiului, produsul din aluminiu joacă rolul unui anod al celulei. Electrolitul este o soluție de acizi sulfurici, ortofosforici, cromici, borici sau oxalici, catodul poate fi un metal care nu interacționează cu soluția electrolitică, de exemplu oțelul inoxidabil. La catod, hidrogenul este eliberat și pe anod se formează o alumină. Procesul total la anod poate fi reprezentat de următoarea ecuație:
2 Al + 3 H20