Proprietăți fizice [ ]
Propilen este o substanță gazoasă, cu punct de fierbere scăzut p.f. = -47,6 ° C și un punct de topire punct topire = -187,6 ° C, densitatea optică a 4 d20 = 0.5193. densitatea aerului = 1,45 (conform manualului lui Baratov)
Proprietăți chimice [ ]
Are o reactivitate semnificativă. Proprietățile sale chimice sunt determinate de o dublă legătură carbon-carbon. p-bond ca cel mai durabil și mai accesibile, în timp ce acțiunea reactivului este rupt și eliberați atomii de carbon de valență sunt cheltuite pe care unește atomii care formează molecula de reactant. Toate reacțiile de adiție se realizează printr-o dublă legătură și constau în scindarea legăturii π a alchenului și formarea a două noi legături σ la locul de rupere.
Adesea, reacțiile de adiție se desfășoară prin tip heterolitic, fiind reacțiile de adăugare electrofilă.
Adăugarea de halogeni (halogenare) [ ]
Reacția de halogenare este de obicei efectuată într-un solvent la temperatura obișnuită. Halogenii sunt ușor atașați la punctul în care dubla legătură se rupe pentru a forma derivați dihalogeni. Mai ușor este adăugarea de clor și brom, mai dificil - iod. Fluorul interacționează cu explozia.
Adăugarea de hidrogen (reacție de hidrogenare) [ ]
H2C = CH # x2212; CH3 + H2 # x2192; H3C # x2212; C H 2 # x2212; CH3 = CH-CH_ + H1 >> \ rightarrow C-CH_-CH1 >>>Prin adăugarea de hidrogen în prezența catalizatorilor (Pt, Pd, Ni), propilena trece în hidrocarbură propan-propan.
Adăugarea de apă (reacție de hidratare) [ ]
Propilenul reacționează cu apă pentru a forma un alcool monohidric de izopropanol. cu dubla legătură fiind dezvăluită.
Adăugarea de halogenuri de hidrogen (HHal) [ ]
Se întâmplă după regula lui Markovnikov. Hidrogenul acidului HHal este atașat la atomul de carbon cel mai hidrogenat într-o dublă legătură. În consecință, restul Hal este legat la un atom de carbon la care se află un număr mai mic de atomi de hidrogen.
Un exemplu de hidrohalogenare este prepararea unui derivat de brom de propan în timpul reacției de bromură de hidrogen și propilenă.
Combustia în aer [ ]
Cu oxigenul în aer, propilena gazoasă formează amestecuri explozive.
Oxidarea [ ]
În mediu apos slab alcalin sau neutru, propilena este oxidată cu permanganat de potasiu. care este însoțită de decolorarea soluției KMnO4 și formarea glicolilor (compuși cu două grupe hidroxil la atomii de carbon vecini). Această reacție a fost numită reacția Wagner.
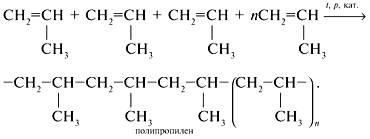
Polimerizarea [ ]
Condiții de reacție: încălzire, prezența catalizatorilor. Moleculele se unesc prin împărțirea legăturilor π-intramoleculare și prin formarea de noi legături intermoleculare.
Oxidarea cu oxigen de aer în propilen oxid [ ]
Când se încălzește în prezența catalizatorilor de argint:
Noțiuni de bază [ ]
În laborator [ ]
1. Desprinderea halogenurii de hidrogen din haloalchii la acțiunea unei soluții de alcool alcalin pe acestea:
3. Deshidratarea alcoolului izopropilic (împărțirea apei). Catalizatorul folosit este acidul (sulfuric sau fosforic) sau Al2O3:
4. Desprinderea a doi atomi de halogen din dihaloalcani. conținând halogeni la atomii C învecinați. Reacția se desfășoară sub acțiunea metalelor (Zn, etc.):
În industrie [ ]
In general, propilena este recuperată din gazele de rafinărie (țiței cracare într-un (proces ferm pat fluidizat BASF), fracții de piroliză benzină) sau gaze libere și gaze din cărbune cocsificabil. Există mai multe tipuri de propilenă de piroliză: a cuptoarele tubulare de piroliză, piroliză în reactor cu cuarț lichid de răcire (companie proces Phillips Petroleum Co.), cocs de piroliză în agentul de răcire a reactorului (Farbewerke Hoechst proces ferm), reactorul de piroliză cu nisip ca mediu de încălzire (fabricat prin procedeul Lurgi), piroliză într-un cuptor tubular (proces Kellogg firmă) proces Lavrovskii - Brodsky, autotermale piroliza Bartolome. În industrie, propilenă a fost preparat prin dehidrogenarea alcanilor, în prezența unui catalizator (Cr2O3, Al2O3).
Procesul industrial de producere a propilenei, împreună cu crăparea, este deshidratarea propanolului peste oxidul de aluminiu:
Odată cu lansarea producției în cazul operațiunilor contabile inventar, verificarea că respectă documentația tehnică de reglementare și propilenă în eșantion în conformitate cu procedura descrisă în CCITT 24,975.0-89 „etilenă și propilenă. Metode de eșantionare.“ eșantionarea propilenă poate fi făcută sub formă gazoasă și gazele lichefiate în prelevator special în conformitate cu GOST 14921.
Aplicație [ ]
Producție [ ]
Cea mai mare parte a capacității de producție a propilenei este concentrată în Europa, America de Nord și Asia. În prezent, peste 50 de milioane de tone de polimer și propilenă chimică (PG / CG) sunt produse în lume pe parcursul anului. Majoritatea eliberării propilenei din aceste soiuri este reprezentată de unitățile de piroliză, în care propilena este un produs secundar al producției de etilenă. Instalațiile de cracare termică produc mai mult de 60% din această propilenă. Rafinamentul petrolier întreprinderile FCC a produs 34%. În procesul de dehidrogenare sau metateză a propanului, se produce 3% propilenă (în acest caz propilena este produsul țintă).
Petrochemical puritate propilenă (RG) este produs în rafinării din lume, o cantitate de 31,2 milioane de tone. Majoritatea propilena este produsă într-o astfel FCC-plante, în care propilenă - un produs secundar al producției de benzină și de distilate. Jumătate din capacitatea propilenei integrate cu companii petrochimice, în care alchilarea propilenă sau amestecuri de GPL și propan.