Vectori virali [edita]
Datorită particularităților ciclului de viață al virușilor, primii vectori (purtători de transgeni) pentru terapia genică au început să se dezvolte pe baza lor. Virușii poartă gene străine, care pot fi apoi exprimate în celule infectate. Simplificat, virusul poate fi considerat ca un acid nucleic ambalat într-o cochilie. Virusul pătrunde în celula țintă, unde se exprimă genomul viral. Pentru a crea un vector bun, trebuie să modificați unele proprietăți ale virusului. În cele mai multe cazuri, virusul trebuie împiedicat să se reproducă pentru a împiedica răspândirea necontrolată a transgenei. În plus, o parte din genomul viral trebuie eliminată pentru a face loc materialului genetic străin. Alte modificări necesare depind de tipul virusului. Vectorii virali sunt utilizați pe scară largă în studiile preclinice și în prezent cele mai multe studii clinice sunt efectuate împreună cu acestea.
Retrovirusuri [editați]
Acestea sunt virusuri mici care conțin ARN capabile să infecteze numai celulele care se separă în care sunt reproduse. Genomul viral (sub formă de provirus) este inserat în ADN-ul celulei țintă. Prin urmare, vectorii retrovirale sunt capabili teoretic să asigure o expresie pe termen lung a transgenei în anumite tipuri de celule. Majoritatea vectorilor retrovirali sunt derivați din virusul de leucemie de la Moloney Mouse. Genomul virusului este modificat pentru a evita exprimarea proteinelor virale în celulele infectate, ceea ce împiedică dezvoltarea unui răspuns imun împotriva acestor celule. Deoarece aceste virusuri infectează numai celulele divizate, vectorii retrovirali sunt utilizați în principal pentru transducția celulelor ex vivo (vezi mai jos) sau pentru tratamentul experimental al tumorilor maligne.
Ciclul de viață. Genomul retrovirusurilor constă în ARN-plus-strand. Plicul retrovirusurilor este format din membrana celulei infectate și conține proteine virale. Pentru replicarea genomului și a ansamblului de viruși sunt necesare trei gene virale - gag, pol și env. In celulele infectate cu un revers transcripția ARN-ului viral la matricea este formată ADN dublu catenar (provirusului), care este apoi integrat în genomul celular. Acest lucru este asigurat de proteinele virale - revers transcriptază și integrază. Pentru a pătrunde provirusul în nucleu, este necesară distrugerea plicului nuclear al celulei, care apare în timpul mitozei. Provirusul încorporat în genomul celular utilizează mecanismele celulare pentru transcrierea mRNA-urilor virale, prelucrarea și traducerea lor. Ciclul de viață al virusului este completat cu sinteza de noi linii plus de ARN pe matricea provirus. O secvență specifică în molecula ARN (psi) dă un semnal de asamblare, după care virușii noi se scot din suprafața celulei.
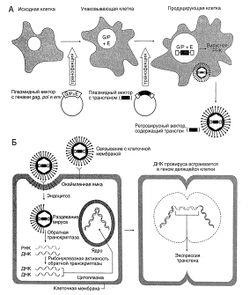
Figura 5.1. Utilizarea unui vector retrovirus. A. Schema de obținere a vectorului retrovirus.
Construcția și recepția unui vector. Vectorii retrovirali sunt obținuți din provirusul corespunzător. Genele gag, pol și env sunt îndepărtate pentru a face loc noului material genetic și pentru a împiedica reproducerea virusului (Figura 5.1). Un vector retrovirus poate include până la 8000 de perechi de nucleotide ADN străine. Deoarece virusul recombinant nu poate sintetiza ARNm viral, nu există o sinteză a proteinelor virale în celulele transfectate care ar putea induce un răspuns imun. Împreună cu gena destinată tratamentului, un promotor și un amplificator pot fi introduse în vector, care asigură o expresie eficientă a transgenei și, în unele cazuri, specificitatea țesutului. De asemenea, puteți utiliza promotorul și amplificatorul viral aflat în regiunea repetițiilor terminale lungi (LTR).
Descrierea pentru Figura 5.1. Utilizarea unui vector retrovirus. A. Schema de obținere a vectorului retrovirus. Pentru a produce vectori retrovirale non-reproductibile, se folosesc linii celulare speciale care pot sintetiza acele proteine virale ale căror gene sunt eliminate în timpul construirii vectorului. În celulele unei linii adecvate (de exemplu celulele embrionare de rinichi umane), genele gag (G), pol (P) și env (E) sunt introduse prin plasmide bacteriene. Celulele care sintetizează proteinele virale corespunzătoare se numesc ambalaje. Apoi, plasmida care conține ADN-ul recombinant al provirusului, în care gena gag, pol și env sunt în locul transgenei dorite, este utilizată pentru a transduce celulele de ambalare. Acum, celulele conțin tot ceea ce este necesar pentru a asambla virusurile, iar vectorii retrovirale încep să se acumuleze în mediul de cultură. Acești vectori conțin o transgenă, dar lipsesc genele virale gag, pol și env și, prin urmare, când celula următoare este infectată, acestea nu pot fi reproduse. B. Expresia transgenei în celula țintă după introducerea vectorului retrovirus care conține ARN (vezi "ciclul de viață").
Securitate. Deoarece virusul este încorporat în genomul celular (care este important pentru exprimarea prelungită), la întâmplare, există un risc de mutație (mutageneză de inserție). De exemplu, încorporarea unui virus poate schimba funcția genei care reglementează diviziunea celulară, ceea ce va duce la consecințe nedorite. Retrovirusurile capabile de reproducere au o anumită carcinogenitate, dar acest lucru nu este observat în vectorii retrovirale care nu au această capacitate.
Lentiviruses [editați]
Utilizarea vectorilor lentivirus aproape nu provoacă inflamații sau alte semne de afectare a țesutului.
Adenoviruses [modifică]
Vectorii adenovirali asigură transducția eficientă atât a celulelor divizante, cât și a celulelor nediferențiate, cu expresia ulterioară a transgenelor. Puteți utiliza diferite căi de administrare, cum ar fi I / O, intraperitoneal, intravezical, intracraniană, intratecală și injectarea în duct biliar sau direct în parenchimul organului. Varietatea modalităților de introducere permite alegerea celor mai bune pentru țintă aleasă. Vectorii adenovirali au două dezavantaje semnificative. Mai întâi, după infectarea celulei, genomul viral nu este inserat în ADN-ul celulei, deci nu există o expresie prelungită a transgenei. În al doilea rând, infecția adenovirală activează atât unitățile celulare și umorale de imunitate, care conduc la distrugerea celulelor transfectate și reduce eficiența introducerii repetate a vectorului. Efectele secundare ale vectorilor adenovirali sunt de asemenea explicate prin răspunsul imun.
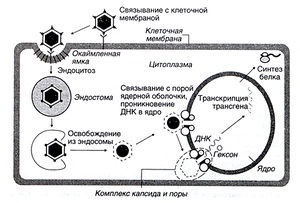
Figura 5.2. Utilizarea vectorului adenoviral.
Deoarece genele E1 sunt implicate în reproducerea adenovirusurilor, blocarea lor blochează sau, cel puțin, complică semnificativ reproducerea. Datorită structurii mai complexe a virusului, este mai dificil să se elimine toate genele adenovirusului din vector decât genele retrovirale. Sinteza proteinelor adenovirale după infectarea celulelor cu vectori adenovirali existenți activează unitățile celulare și umorale de imunitate. În unele cazuri, acest lucru poate limita utilizarea vectorului datorită morții celulelor transfectate și eficienței reduse a reintroducerii vectorilor.
Descrierea pentru Figura 5.2. Utilizarea vectorului adenoviral. Adenovirusul adenovirus se leagă la receptorii specifici de pe suprafața celulei țintă și îl penetrează prin endocitoză. Proteinele virale furnizează ieșirea virusului de la endozom la fuziunea sa cu lizozomul; datorită acestui virus evită distrugerea. ADN-ul adenoviral este eliberat din proteine și penetrează în nucleu, unde începe sinteza noului ARNm. În acest caz, ADN-ul adenoviral care conține transgena nu este inserat în genomul celulei gazdă.
vectori adenovirali într-o cantitate mare obținută prin infectarea unei celule de ambalare (de obicei, o linie de celule embrionare de rinichi uman 293) care exprimă proteina virală E1, care compensează lipsa genei corespunzătoare din virusul recombinant. Celulele infectate sunt apoi lizate și lizatul este centrifugat într-un gradient de densitate a clorului de cesiu. Această metodă permite nu numai purificarea virușilor din alte componente ale culturii celulare, ci și concentrarea acesteia, având mai mult de 1013 viruși per 1 ml. Virusul purificat este foarte stabil în diferite soluții tampon, iar pentru depozitarea pe termen lung poate fi înghețat fără pierderea activității.
Aplicație. În prezent, există numeroase studii clinice în care vectorii adenovirali sunt utilizați pentru a trata atât bolile ereditare, cât și cele dobândite. In tratamentul bolilor ereditare cel mai important dezavantaj este durata scurtă a exprimării transgenei și răspunsul imun la celula infectată. Extracromozomiali genomului localizare adenoviral în celula limitează durata expresiei transgenei în celulele care se divid activ (de exemplu, celule de măduvă osoasă sau de epiteliu), deoarece diviziunea celulară nu este însoțită de replicare transgenică. Vectorii adenovirali sunt capabili și incapabile de reproducere, poate găsi aplicare în tratamentul afecțiunilor maligne (vezi. de mai jos).
Aplicație. Adeno-asociate vectori au început să fie aplicate în clinică: studiile clinice sunt în prezent în curs de desfășurare pentru a furniza gene la plămâni și mușchii scheletici. Aparent, acești vectori sunt adecvați pentru a asigura expresia pe termen lung a transgenelor în mușchii, inima, SNC și alte țesuturi scheletice. Primele rezultate ale studiului clinic, în care gena factorului IX a fost transmisă mușchilor scheletici ai hemofiliei de vectorul adeno-asociat, au avut succes (vezi mai jos). Capacitatea acestor vectori de expresie prelungită furnizează transgenică, fără a provoca efecte toxice asupra celulelor si nu cauzeaza un raspuns imun, ceea ce le face instrument promițător pentru tratamentul anumitor boli ereditare.