APĂ (oxid de hidrogen) H2O, greutate moleculară 18.016, cel mai simplu compus hidrogen stabil cu oxigen. Lichid fără miros, gust și culoare.
Distribuția în natură. Apa este unul dintre compușii cei mai obișnuiți de pe Pământ. Molecule de apă se găsesc în spațiul interstelar. Apa este o parte a cometelor, majoritatea planetelor sistemului solar și a sateliților lor. apa Max pe pământ este estimat a fi 1,39 x 10 18 tone, o mare parte din ea este conținută în mări și oceane. Numărul maxim disponibil pentru utilizarea de apă proaspătă în râuri, lacuri, mlaștini și rezervoare este 2 x 10 4 t. Masa din Antarctica gheață din Antarctica și zonele muntoase 2,4 x 10 16 t, are aproximativ același număr de apă subterană, cu doar o mică parte - proaspătă. În straturile adânci ale pământului conține mult mai mult (aparent, nu mai puțin de un ordin de) apă decât la suprafață. În atmosferă este de aprox. 1,3 * 10 13 tone de apă. Apa este o parte din mai multe minerale și roci (argilă, gips etc.) prezente în sol, este obligatorie. componentă a tuturor organismelor vii.
Structura moleculei și proprietățile sale fizice. Atomii hidrogenului și oxigenului din molecula de apă sunt situați în colțurile unui triunghi isoscel cu lungimea legăturii OH de 0,0957 nm; unghiul de valență de H-O-H 104,5 °; dipol moment 6.17 * 10 -30 Cl * m; polarizabilitatea moleculei este 1,45 x 10 -3 nm 3; Momentul mediu quadrupol este 1,87 * 10 -41 Cl * m 2. Energia de ionizare este de 12,6 eV, afinitatea pentru proton este de 7,1 eV. Atunci când molecula de apă interacționează cu alți atomi, molecule și ioni, cu alte molecule de apă în condensator. , acești parametri se schimbă.
Anumiți parametri care caracterizează proprietățile apei în diferite stări agregate la atmosfere. sunt prezentate mai jos (a se vedea și tabelul 1 și figura 1, unde sunt indicate regiunile existente ale diferitelor modificări ale gheții):

Nat. proprietățile apei sunt anormale. Topirea gheții în atmosferă. presiunea este însoțită de o scădere a volumului de 9%. Coeficientul de temperatură de expansiune volumetrică a gheții și a apei lichide este negativ pentru m-pax, respectiv sub -210 ° C și 3,98 ° C Capacitatea de căldură a C ° în timpul topirii crește aproape dublu, iar în intervalul 0-100 ° C este aproape independentă de temperatură (există un minim la 35 ° C). Compresibilitatea minimă izo-termodinamic (44,9 x 10-11 Pa-1), observată la 46 ° C, este exprimată destul de clar. La presiuni scăzute și temperaturi de până la 30 ° C, viscozitatea apei scade odată cu creșterea presiunii. Diversitatea permitivității dielectrice și a momentului dipol al apei determină buna sa putere de dizolvare în ceea ce privește substanțele poliare și ionogene. Datorită valorilor ridicate ale C ° și a apei - un regulator important este climatic. condiții la sol, stabilizând temperatura pe suprafața sa. În plus, proximitatea unghiului H-O-H față de tetraedrică (109 ° 28 ") determină flocularea structurilor de gheață și a apei lichide și, ca o consecință, dependența anormală a densității de temperatura. Prin urmare, iazurile mari nu îngheață până la fund, ceea ce face viața posibilă în ele.
Tabel. 1 - PROPRIETĂȚILE APEI ȘI A APEI ACOPERITE ÎN EQUILIBRIU
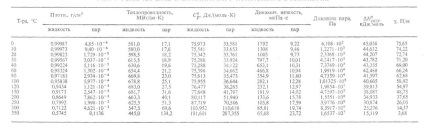
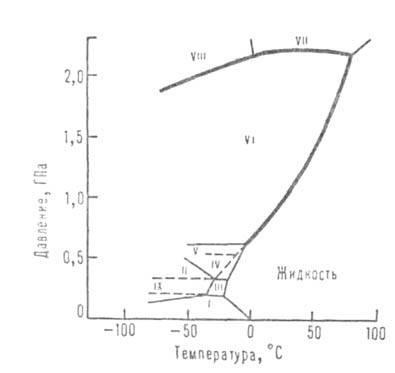
Fig. 1. Diagrama fazelor apei.
Interacțiunea dintre moleculele de apă. Structura fazelor condensate. Moleculele de apă, având un moment dipol semnificativ, interacționează puternic între ele și cu moleculele polare ale altor substanțe. În acest caz, atomii de hidrogen pot forma legături de hidrogen cu atomii de O, N, F, CI, S și colab. Aburul la temperaturi scăzute și presiuni moderate, prezintă o cantitate mică (aproximativ 1%, la temperatura de fierbere și atm. Presiunea) dimerilor apă ( pentru ei
15 kJ / mol), distanța dintre atomii de oxigen
0,3 nm. În fazele condensate, fiecare moleculă de apă formează patru legături de hidrogen: două - ca donator de protoni și două - ca acceptor de protoni. Lungimea medie a acestor legături în cristalină. modificările de gheață și hidrații cristalini de aprox. 0,28 nm. Unghiul O-N. 0 tinde la 180 °. Cele patru legături de hidrogen ale moleculelor de apă sunt direcționate aproximativ către vârfurile tetraedrului obișnuit (figura 2).
Structura modificărilor de gheață este o rețea tridimensională. În modificările dense ale lui VI-VIII, care sunt stabile la presiuni mari, se pot distinge chiar și două astfel de grile, "introduse" în cealaltă. În modificările existente la presiuni scăzute (gheață Ih și Ic), legăturile H-O-H sunt aproape rectiliniare și direcționate spre vârfurile unui tetraedru practic obișnuit. În modificările de la II-VI, legăturile sunt curbate, iar unghiurile dintre ele diferă de tetraedru, ceea ce determină o creștere a densității în comparație cu densitatea gheții obișnuite.
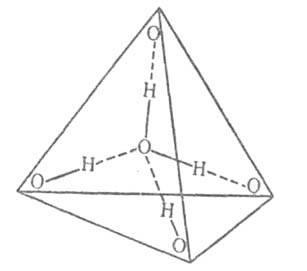
Fig. 2. Schema tetraedrică. coordonarea moleculei de apă; linii solide - legături covalente; liniile întrerupte sunt legături de hidrogen.
Dar densitatea modificărilor II-VI este mult mai scăzută decât cea pe care o poate avea gheața dacă moleculele sunt împachetate bine. Numai modificările VII și VIII a atins o densitate suficient de mare de ambalare: în lor grilă drept structură cu două construit din tetraedre, Introdus una într-alta, (comparabilă cu cea a gheții cubica temperatură scăzută Ic diamant izostructurali.) în timp ce sistemul de legături de hidrogen rectilinie este reținut și coordonata este păstrată. dublarea numărului de oxigen ajunge și 8. Localizarea atomilor de oxigen din VII și VIII de gheață ca și aranjamentul atomilor lor vzheleze și multe altele. metale. În condiții normale (Ih) și cubic (Ic), gheață, și nu este definită în gheață HI, V-VII orientare moleculară: Atât cea mai apropiată de o formă de proton atom O cu ea o legătură covalentă, care poate fi direcționat către oricare doi dintre cei patru atomi de oxigen vecine la vârfurile tetraedrului. Dielectrică. permeabilitatea acestor modificări este ridicată (mai mare decât cea a apei lichide). Modificările II, VIII și IX sunt ordonate oriental; permeabilitatea lor dielectrică este scăzută (aproximativ 3). Ice VIII este o versiune comandată a aranjamentului de gheață protoni VII și gheață IX - gheață III. Densitățile modificărilor ordonate oriental (VIII, IX) se apropie de densitățile dezordonate corespunzătoare (VII, III).
O rețea tridimensională de legături de hidrogen, construită din tetraedru, există și în apă lichidă în întregul interval de la punctul de topire la cel critic. Creșterea densității în timpul topirii, ca și în cazul modificărilor dense ale gheții, se datorează îndoirii legăturilor de hidrogen și devierea unghiurilor dintre ele din tetraedru. Curbura legăturilor crește cu creșterea temperaturii și a presiunii, ceea ce duce la o creștere a densității. Pe de altă parte, când este încălzită, lungimea medie a legăturilor de hidrogen devine mai mare, ca urmare a scăderii densității. Acțiunea combinată a celor doi factori explică prezența unui maxim de densitate a apei la 3,98 ° C
Proprietăți chimice. Doar o mică parte din molecule (la 25 ° C - aproximativ 1 pe 5 * 109) suferă electroliză. disocierea conform schemei: H2OH + + OH -. Protonul H + în mediul apos, interacționând cu moleculele de apă, formează H3O +. combinată cu o moleculă de H2O în H5O2 +. Distanța O.O în astfel de complexe este considerabil mai scurtă decât lungimea legăturii normale de hidrogen între moleculele neutre. Dar, deoarece protonul, aparent, nu este exact în mijlocul acestei legături scurte, dar mai aproape de unul dintre atomii de O, se poate presupune că există un hidon hidroxidat H3O + în apă. Acest fenomen joacă un rol important în procesele chimice care apar în diferite sisteme, inclusiv cele biologice. În special, disocierea apei este cauza hidrolizei sărurilor de acizi slabici și (sau) baze. Concentrația ionilor de H + și concentrația de ioni de OH asociate cu acesta sunt caracteristici importante ale soluțiilor apoase (a se vedea indicele Hidrogen). Gradul de electroliză. Disocierea apei crește considerabil odată cu creșterea temperaturii.
Formarea elementelor de apă prin H reacție 2 + 1/2 O2 H2O (H O mod -242 kJ / mol pentru abur și -286 kJ / mol pentru apă în stare lichidă) la temperaturi scăzute în absența catalizatorilor este extrem de lent, dar crește rata de reacție brusc când temperatura crește, iar la 550 ° C se produce o explozie. Cu o scădere a presiunii și o creștere a temperaturii, echilibrul se schimbă spre stânga. Gradul de disociere a apei termodinamic (%) la 100 kPa: 0,034 (1015 ° C) 0,74 (1711 ° C) 8.6 (2215 ° C) și 11,1 (2483 ° C). Sub influența radiației UV, apa disociază în ioni H + și OH -. Radiația ionizantă determină radioliza apei cu formarea H2. H2O2 și radicalii liberi; radiații. randamentul este de aproximativ 4 molecule defalcate pentru fiecare 1,6 * 10 -17 J absorbit de energie de radiații.
Apa este un compus reactiv. Este oxidat de oxigenul atomic: H2O + O -> H2O2. Când apa interacționează cu F2, se formează HF, precum și O, O2. O3. H2O2. F2O și alți compuși. Cu restul de halogeni la temperaturi scăzute, apa reacționează pentru a forma un amestec de acizi HHal și HNalO. În condiții normale cu apă, reacția la jumătate de Cl2 se dizolvă în el și se produc cantități mult mai mici de Br2 și 12. clorul și bromul descompun apă pentru a forma HHal și O2. Când vaporii de apă trec prin cărbunele încălzite, se descompun și se formează un așa numit gaz de apă: H2O + CO + H2. Cu mai mare. temperatura în prezența catalizatorului, apa reacționează cu hidrocarburi cu CO, CH4 etc., de exemplu: H2O + CO2 + H2 (catalizator Fe); H20 + CH4CO + 3H2 (catalizator Ni sau Co). Aceste reacții sunt utilizate pentru bal. producția de H2. Perspectiva producerii sale este, de asemenea, metodele termochimice de descompunere a apei (vezi Hidrogen, Hidrogen Energie). Fosforul, când este încălzit cu apă sub presiune în prezența unui catalizator, este oxidat în acid metafosforic: 6H20 + 3P -> 2HP03 + 5H2. Interacțiunea apei cu multe metale cu formarea H2 și a hidroxidului corespunzător. Cu alcalin și cu pământ. metale (cu excepția Mg), această reacție continuă deja la temperatura camerei. Metalele mai puțin active descompun apă la temperaturi mai ridicate. temperatură, de exemplu Mg și Zn - peste 100 ° C, Fe - peste 600 ° C (2Fe + 3H2O-> Fe2O3 + 3H2). Atunci când se reacționează cu apă de multe oxizi, se formează acizi sau baze. Apa poate servi drept catalizator, de exemplu, metalele alcaline și hidrogenul reacționează cu clorul numai în prezența unor urme de apă. Uneori apa este o otravă catalitică, de exemplu pentru un catalizator de fier în sinteza NH3.
Capacitatea moleculelor de apă de a forma rețele tridimensionale de legături de hidrogen îi permite să dea cu gaze inerte, hidrocarburi, CO2. Cl2. (CH2) 20, CHCI3 și multe alte substanțe, așa-numitele hidrați de gaz.
Apa ca solvent. Apa bine dizolvă mulți ioni polari și disociați în ioni. De obicei, solubilitatea crește odată cu creșterea temperaturii, dar uneori dependența de temperatură este mai complexă. Astfel, solubilitatea multor sulfați, carbonați și fosfați ca temperatura crește sau descrește la mai întâi crește și apoi trece printr-un maxim. Solubilitatea substanțelor polară scăzută (inclusiv gazele care alcătuiesc atmosfera) în apă este scăzută și, odată cu creșterea temperaturii, de obicei scade și apoi trece printr-un minim. Cu o presiune tot mai mare, solubilitatea gazelor crește, trecând la presiuni ridicate printr-un maxim. Multe substanțe, care se dizolvă în apă, reacționează cu ea. De exemplu, ionii NH4 pot fi prezenți în soluțiile de NH3 (vezi de asemenea Hidroliza). Între ionii dizolvați în apă, atomi, molecule care nu intră într-o reacție chimică cu acesta și molecule de apă, nu există ioni-dipoli și ioni intermolecari care le distrug. (vezi Hidratarea).
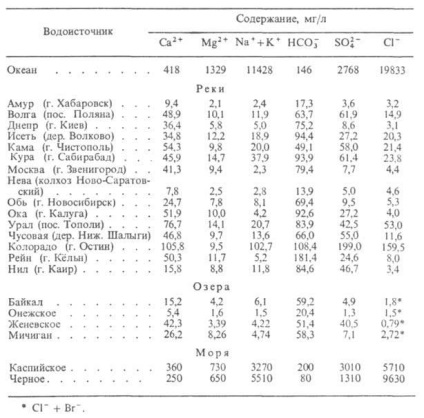
Apă naturală. Acesta este un sistem multi-component complex, care constă din substanțe minerale, gaze, precum coloidal și particule grosiere, inclusiv microorganisme. Amploarea mineralizare (g / l) distinge următoarele apa naturală: ultrafresh - până la 0,2, în stare proaspătă - 0,2-0,5 sălcie - 0.5-1.0, sălcie - 1-3, sărate - 3- 10, cu elev. salinitate - 10-35, tranziția la saramuri - 35-50, saramuri - 50. macrocomponent mai multă apă naturale sunt în mod tipic Ca, Mg, Na, K, Fe (apa cationic), Si, C, S, CI (apă anionic). Prin microcomponentelor includ apa naturală și minereu elemente rare precum B, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, I și altele.
DOS. gazele conținute în apa naturală - CO2. N2 (tipic pentru condițiile de suprafață și de suprafață), CH4. CO, H2 (mai tipic pentru apele subterane și pentru apa din regiunile active vulcanice). Componentele dizolvate în apă sunt în echilibru, formând complexe cu compoziție diferită. Datele privind compoziția unor ape naturale sunt prezentate în tabelul. 2.
Tabel. 2-COMPOZIȚIA APEI NATURALE
Apă potabilă. Numărul total de microorganisme în 1 ml de apă potabilă nu trebuie să fie mai mare de 100, numărul de bacterii coliforme (indicele coliforme) - nu mai mult de 3. Concentrația substanțelor chimice care se găsesc în apă naturală sau adăugat în apă în timpul prelucrării (a se vedea apa). , nu trebuie să depășească (mg / l):

Apă tehnică. Apa consumată de bal. întreprinderi, se numește tehnică. Acesta este utilizat în principal ca mediu lichid de răcire pentru transportul materialelor în vrac (de exemplu, cenușă hydrotransport în termocentrale), solvent și altele. În general, toate industriile 70-75% din fluxul total este folosit ca agent frigorific pentru circulație. schemă. În acest caz, apa se încălzește și nu este practic contaminată. Principalele surse de contaminare a apei de răcire a sistemelor de circulație. alimentare cu apă - apă, adăugat la sisteme pentru a compensa pierderile inevitabile și bancomat. aerul, substanțele suspendate și gazele solubile în apă sunt spălate din c-poro în răcitoarele de apă.
Ape de vindecare. În utilizarea terapeutică ca apă naturală care conține o cantitate considerabilă leafminer, saruri, gaze, unele elemente și altele. (A se vedea. Apa minerală).
În ultimii ani, calitatea apei potabile sa deteriorat semnificativ. Motivul pentru aceasta a fost o creștere semnificativă a emisiilor poluante, atît interne, cît și produse de întreprinderile industriale. Acum, în apă se găsesc contaminări chimice, biologice și chiar radioactive, care au un efect foarte negativ asupra sănătății umane. Acest lucru poate explica interesul puternic crescut în sistemele de purificare a apei. atât în rândul cumpărătorilor, cât și al producătorilor. Gândindu-te la sănătatea ta, mai mulți oameni instalează sisteme de purificare a apei în apartamente, cabane, cabane.