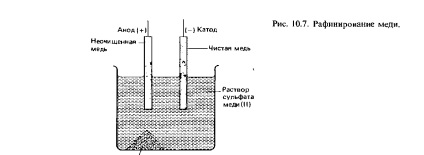
Purificarea metalelor, cum ar fi cuprul și zincul, poate fi realizată prin electroliză. Purificarea metalelor se numește rafinare (vezi secțiunea 10.5). În Fig. 10.7 prezintă schematic procesul de purificare a cuprului. Cuprul nerafinat joacă un rol anod în acest proces, iar cuprul purificat joacă rolul unui catod; O soluție de sulfat de cupru (II) poate fi utilizată ca electrolit. La anod, o jumătate de reacție
Cu (s) = Cu2 + (aq) + 2e-
Impuritățile eliberate prin dizolvarea cuprului nerafinat la anod sunt coborâte la fundul celulei, formând astfel așa numitul nămol anodic. Acest nămol poate conține metale prețioase, de exemplu aur și argint. Ioni de cupru care trec în soluție sunt evacuați și depozitați pe un catod pur de cupru. Această jumătate de reacție este descrisă de ecuație
Cu2 + (aq) = Cu (s) + 2e-
Impurități (nămol anodic)
Aplicarea acoperirilor galvanice
În acest proces, acoperirea (electrodepunerea) se realizează pe catod. Catodul este scufundat într-un electrolit care conține ionii metalului electrodepozitat. Ca anod se folosește o placă sau o tijă din metalul de acoperit. Pentru desfășurarea cu succes a galvanizării, rezistența curentului electric, concentrația electrolitului și temperatura trebuie monitorizate îndeaproape. În plus, este necesară pre-curățarea catodului.
Aplicarea unei acoperiri cu galvanizare poate include un număr de etape. De exemplu, acoperirea cu fier cu crom implică patru etape:
1. Curățarea obiectului de fier, care joacă rolul unui catod, cu acid sulfuric, urmat de clătire cu apă deionizată.
2. Acoperirea catodului de fier cu cupru.
3. Acoperirea ulterioară a catodului cu nichel pentru a preveni coroziunea.
4. Acoperirea finală a obiectului cu crom.
Acesta este numele procesului de acoperire a obiectelor din aluminiu cu oxid de aluminiu. În acest proces, obiectul acoperit joacă rolul unui anod, iar acidul sulfuric diluat este utilizat ca electrolit. Acoperirea cu alumină protejează obiectul de coroziune.
Obținerea de substanțe chimice
Cel mai important exemplu al unei astfel de aplicări a electrolizei este producerea hidroxidului de sodiu, hidrogen și clor într-o celulă electrochimică cu un catod de mercur. O descriere detaliată a acestui proces este prezentată în Sec. 13.3.
Pe suprafața particulelor coloidale suspendate în soluție, sunt adesea încărcări electrice datorate adsorbției ionilor sau a electronilor. De exemplu, particulele de aur din cenușa de aur se adsorb pe ionii lor de hidroxid de suprafață. Când curentul electric trece prin sol, particulele de sol încărcate negativ migrează la anod (Figura 10.8). Migrarea particulelor coloidale încărcate la un electrod se numește electroforeză. (Un alt nume pentru electroforeză este catoforația.)
Electroforeza găsește aplicații importante în inginerie, medicină și biochimie. Acesta poate fi folosit pentru a separa, identifica și cuantifica proteine și grăsimi (vezi secțiunea 20.3) în sânge.