
Blocatoarele de miostatină inhibă acțiunea myostatinei, o proteină specifică responsabilă de reglarea și restricționarea creșterii țesutului muscular. Acest lucru duce la faptul că mușchii vor rămâne "pompați", ca și cum sportivul continuă să meargă la sala de sport în fiecare zi, deși de fapt și-a încetat îndelung studiile.
În ultimele decenii, căutarea de căi de restaurare și de creștere a masei musculare nu au fost numai folosind droguri mici molecula anti-catabolice și anabolici, și DD, dar, de asemenea, de căutare la nivel de gene responsabile pentru homeostazia țesutului muscular. Obiectul de a detecta astfel de gene au fost bovine în special carne de vită rasa cu fenotipul unui mușchi dublu așa-numita (rasa Belgian Albastru și Piedmontese)
Taurul rasei este albastru belgian. Odată cu creșterea semnificativă a tuturor grupurilor musculare, există aproape absența țesutului adipos subcutanat.


Ca urmare a acestor experimente, sa demonstrat că proteina GDF-8 este un regulator negativ al creșterii mușchilor scheletici. Prin urmare, a fost numit miostatin. și animalele cu astfel de defecte - myostatin-mouse zero.
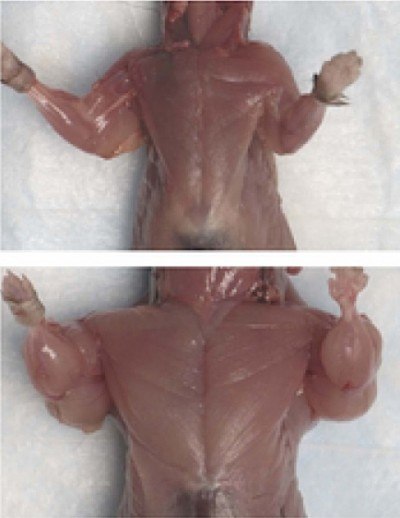
Capacitatea de a restricționa miostatinei cresterea masei musculare a atras imediat atentia ca o tinta potentiala pentru interventie terapeutica pentru boli degenerative, traume si alte patologii ale sistemului musculo-scheletic, precum și - pentru utilizarea în medicină sportivă și sport.
Sa constatat că myostatin structura sa se referă la proteine, cum ar fi TGF-beta (factorul de creștere transformant beta, creșterea transformiruyushy factor-beta), care sunt secretate factori necesare, atât în timpul embriogenezei și în homeostazia tisulară pentru adulți.
Myostatin are proprietăți structurale comune cu alte proteine din familia TGF-beta:
un nucleu hidrofob în regiunea părții N-terminale a moleculei care servește ca un semnal secretor;
un bloc conservat de patru aminoacizi în jumătatea C-terminală a moleculei, care este un semnal pentru procesare (scindare proteolitică în timpul formării proteinei active din precursorul cu o lungime mai lungă);
nouă resturi de cisteină în partea C-terminală a moleculei, necesară pentru formarea unei structuri secundare active funcționale. După procesare, domeniul C-terminal, care devine o miostatină activă funcțional. rămâne ne-covalent legat de partea N-terminală a moleculei, care în acest caz se numește propeptidă;
miostatina. cum ar fi alte proteine cum ar fi TGF-beta, este secretat ca un complex inactiv cu o propeptidă.
Procesul de exprimare a miostatinei. posibil reglată de proteina Titin-cap, deoarece s-a stabilit că sinteza acestei proteine reduce randamentul miostatinei din celule. Secretat ca un complex cu propeptidă, miostatina este inactivă, deoarece nu se poate lega de receptorul său. Pentru manifestarea activității, miostatina trebuie separată de propeptidă. Activarea miostatinei se datorează scindării propeptidei de proteaze cum ar fi catepsina D.
Se crede că cele mai multe dintre miostatină sintetizat își exercită efectul în mod autocrin și paracrin, adică. E. Myostatin acționează în celulele sale sintetizează și în imediata vecinătate. Dar, recent, în experimente a fost demonstrată posibilitatea de a-și manifesta activitatea în mod endocrin, adică efectul sistemic al miostatinei sintetizate local pe toate grupările musculare.
Pentru a-și afișa efectul, miostina trebuie contactată cu receptorul. Sa demonstrat că miostatina interacționează cu receptorii activin ActRIIB. Șoarecii cu receptori ActRIIB modificați incapabili de legarea miostatinei de semnalul din interiorul celulei au, de asemenea, musculare crescută, ca șoarecii cu miostatină-zero.
În embriogeneza, expresia genei de miostatină începe în celulele progenitoare ale liniei miogene și continuă în mușchii axiali și paraxiali adulți. În același timp, nivelul sintezei miostatinei este diferit în cazul diferitelor mușchii scheletici.
Studiile ulterioare au evidențiat expresia genei de mosostatină într-un număr de alte țesuturi. Este demonstrat că miostatina se află în cardiomiocite și fibrele Purkin din inimă, sinteza ARNm myostatin se găsește în glandele mamare și adipocite.
Se poate presupune că diferențele de sex în cantitatea de miostatină secretă. împreună cu alți factori, afectează dimorfismul sexual în dezvoltarea musculaturii scheletice. Cu același nivel de sinteză a mARN-ului de miostatină. adică nivelul expresiei genei de miostatină, nivelul de miostatină secretat este mai mare la femei decât la bărbați.

Deoarece expresia genei miostatinei, care a început în embriogeneză, continuă în mușchii și mușchii postnatali ai unui organism adult, apoi în miostină. Se pare să joace un rol important în toate etapele de miogeneză în homeostaziei țesutului și mușchilor scheletici la adult sub influența diferitelor stimulente funcționale, inclusiv imobilizarea.
Activarea genelor MyoD și Myf5 dă naștere liniei celulare miogene, celulele progenitoare (celulele progenitoare) dau naștere la mioblaste. Activarea genei myogenin stimulează mioblastele să se divid (prolifera) și apoi să se diferențieze. Miostatina. activând gena p21 și sinteza proteinelor Smad, limitează (sau oprește) proliferarea mioblasturilor. Myoblastele, care au încetat să se împartă, ajung la stadiul de morfogeneză, adică la așezarea precursorilor fibrelor musculare - miotuburi. Interacționându-se unul cu celălalt, ele sunt construite în lanțuri și îmbinate în celule multinucleare alungite (sincițiu). După fuziune începe diferențierea membranei, diferențierea biochimică și citoplasmică, rezultând formarea de fibre musculare mature formate în final.
miofibre mature sunt produsul diferențierii terminale, m. E. Nici ei, ca structura ca un întreg sau celule nuclee în interiorul fibrelor nu poate fi divizată și creșterea musculară și regenerare sunt efectuate prin celula satelit npoliferatsii. Celulele satelit au dimensiuni apropiate de cele ale nucleelor musculare ale fibrelor musculare și, asemenea acestor nuclee, sunt situate pe periferia fibrelor musculare. Numai microscopia electronică a făcut posibilă stabilirea faptului că acestea sunt separate fizic de fibrele musculare mature și sunt situate între sarcolemă și membrana bazală.
În fibrele musculare, cantitatea de citoplasmă pe nucleu este în anumite limite destul de restrânse (domeniul myonucleic). Creșterea mărimii fibrei (hipertrofiei) se realizează prin fuziunea celulelor de proliferare cu fibre, astfel încât dimensiunea domeniului myonuclear rămâne în limitele aceleași ca înainte de hipertrofie. Motivația pentru divizarea (proliferarea) celulelor prin satelit în organismele adulte este în primul rând traumatism, inclusiv la nivelul unei fibre musculare individuale. La ieșirea din starea de repaus, celulele satelitului încep să-și exprime markerii miogenici, adică genele care sunt caracteristice mioblastelor sunt activate. În procesul de regenerare a mușchilor scheletici afectați, celulele prin satelit se îmbină cu fibrele musculare existente (hipertrofia) sau între ele, creând fibre noi (hiperplazie).
Determinând proporția celulelor satelit din țesutul muscular, este mai convenabil să comparăm miofibrilele și celulele satelitului în funcție de numărul de nuclee, deoarece fibrele musculare sunt multi-nucleare. În stadiul adult, nucleele celulelor satelit reprezintă 2-7% din numărul total de nuclee din diferitele mușchi. La naștere, nucleul celulelor satelit reprezintă aproximativ 30% din numărul total de nuclee din mușchii membrelor inferioare. Aceste celule satelit neonatale proliferează și se îmbină cu fibrele musculare în creștere, ducând la acestea nuclee suplimentare în timpul creșterii postnatale a mușchilor scheletici.
Ca răspuns la myotrauma, celulele satelit sunt activate și proliferate. O parte din celule după divizare este readusă într-o stare de repaus (pentru a restabili grupul de celule-sateliți). Partea principală a celulelor ca urmare a chemotaxia migrează spre zonele deteriorate, și în funcție de gradul de deteriorare sau fuzionează cu deteriorate din fibre musculare sau prin satelit celule fuzionează una în alta formând o nouă fibră. Nucleul celulelor satelitului care au fuzionat recent se află în centrul fibrelor. Întrucât structurile intracelulare ale fibrei sunt restabilite, ele migrează către periferie.
Astfel, celulele prin satelit oferă menținerea stării funcționale a mușchiului scheletic al organismului adult. Acestea sunt necesare pentru a repara fibrele musculare deteriorate și sunt o sursă de nuclee suplimentare în hipertrofiei musculare, ca urmare a sesiunilor de formare. Hipertrofia și (sau) hiperplazia musculaturii scheletice la animale cu lipsa miostatinei funcțional activă demonstrează că myostatin afectează proliferarea celulelor prin satelit, deoarece are loc creșterea musculară postnatale și creșterea numărului de nuclee din fibre musculare în timpul dezvoltării până la maturitate datorită proliferării celulelor prin satelit .
Odată cu activarea celulelor prin satelit (ieșirea din starea de odihnă), genele caracteristice ale mioblastelor încep să funcționeze în ele, astfel încât celulele satelitului devin mioblaste. Gradul de proliferare a celulelor satelitare în mușchii adulți este de asemenea limitat de miostatină, la fel ca proliferarea mioblastelor în embriogeneză. Sa demonstrat că proteina TGF-beta inhibă, de asemenea, proliferarea celulelor satelit din cultură.
Rolul myostatinului în homeostazia fibrelor musculare mature nu a fost încă pe deplin elucidat, dar există o serie de studii asupra nivelului de sinteză ca mRNA de miostatină. și foarte miostatina în mușchi în starea adultă la modele animale și la oameni în condiții fiziologice diferite.
Astfel, supraexpresia sistemică a miostatinei la șoareci timp de două săptămâni duce la o pierdere de peste 30% în greutate corporală totală și masa musculară de 50%, m. E. Picture sindrom casexia practic identic la om. Se constată că miostatina poate acționa endocrină. Introducerea inhibitorilor de propeptidă de myostatin sau follistatin încetinește semnificativ pierderea masei musculare cu un nivel crescut de miostatină.
De asemenea, este important de observat faptul că, împreună cu pierderea masei musculare, apare o pierdere aproape totală de grăsime subcutanată, care este, de asemenea, de acord cu datele privind efectul miostatinei asupra diferențierii adipocitelor.

Concentrațiile intramusculare și serice ale miostatinei sunt crescute la pacienții cu SIDA în stadiul în care există o pierdere a masei musculare. În același timp, concentrația de myostatină se corelează invers cu indicele net al greutății corporale. Aceste rezultate arată că miostatina contribuie la pierderea masei musculare la SIDA și că blocantele de miostatină pot fi utile în medicină.
In experimente directe pe șobolani au arătat că pierderea masei musculare care apare in timpul zborului spatial, asociat cu nivele crescute de miostatină în mușchiul scheletic (2-5 ori în diferite mușchi de ziua a 17-a zborului). Aceste rezultate arată că miostatina este unul dintre elementele principale ale fiziopatologiei multifactoriale a atrofiei musculare care are loc în condiții de zbor în spațiu.
În studiile la sol care implică oameni, sa stabilit că până în a 25-a zi a regimului imobiliar (ca model de zbor spațial), nivelul myostatinei crește cu 12%.
musculare Imobilizarea la soareci conduce la concentrații crescute de ARNm myostatin (expresia genelor myostatin) la nivelul mușchilor imobilizați după 24 de ore de experiment, deși pierderea masei musculare începe numai după a treia zi. Rezultatul cel mai surprinzător obținute în aceste experimente a fost că myostatin diferit semnificativ sinteza în mușchi care conțin diferite izoforme (variante) ale lanțului greu de miozină. Când sinteza de imobilizare myostatin au crescut semnificativ in bystrosokraschayuschihsya musculare fibrele atrofiat că ziua a șaptea de 17%, în timp ce m. soleus, în care sinteza miostatinei nu a fost detectată, atrofizată în aceeași zi cu 42%. M. soleus constă numai din fibre de tip I și Pa, în timp ce m. gastrocnemius și așa mai departe plantaris sunt tipurile IId / x și IIb, deși conțin tipuri I și Ha. Singura explicație acceptabilă pentru acest fenomen este efectul miostatinei sintetizate de m. gastrocnemius și ha. plantaris, la m. soleus, adică efectul endocrin.
O altă explicație este că sinteza myostatin este corelată cu tipul de fibre, adică. E. Sinteza myostatin în imobilizarea mușchilor la șoareci se corelează cu izoenzimei lanț greu de miozină IIb.
In modelul de distrofie musculară Duchenne (linia de șoarece mdx) demonstrează că blocante myostatin (anticorpi prin miostatina injecție intraperitoneală) timp de trei luni, conduce la creșterea masei musculare, marimea si forta musculara. Hibrizii șoarecii cu șoarecii mdx miostatină zero au o semnificativ mai bune decât mușchii condiție linia mdx mouse-ul original. condiție musculare șoareci Normalizarea în linie mdx sau prin blocarea myostatin de trecere Myostatin zero cu soareci deschide noi posibilități pentru tratamentul stărilor patologice care implică pierderea masei musculare.
Acum peste patruzeci de ani, sa sugerat existența inhibitorilor specifici țesutului - chalones (chalones), care sintetizează acest tesut, inhiba creșterea și, prin urmare, să mențină o masă adecvată a acestui material. Această ipoteză a fost confirmată ulterior în cazul musculaturii scheletice.
Sursa: Farmacologie sportivă (Seifulla)
