Fig. 5. Coroziunea la contactul a două metale
Influența eterogenității compoziției mediului coroziv poate duce la formarea microhalvanoparilor chiar pe suprafața aceluiași metal. Un exemplu este coroziunea
metal sub picătură de apă (figura 6). Deoarece straturile de apă de suprafață conțin oxigen dizolvat mai mult decât suprafața metalică internă, în centrul unei picături este mai activă (porțiunea de anod), iar la periferia picăturii va observa reducerea oxigenului (porțiunea catod). Dupa uscarea picaturii, apare o pata de ruginie destul de adanca in centrul ei.
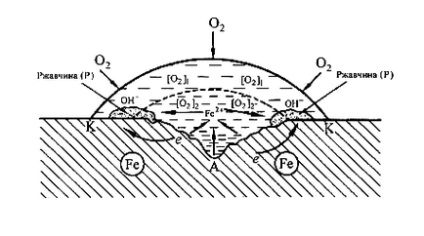
Fig. 6. Schema de coroziune a fierului sub picătură de apă
Astfel de oțeluri galvanice apar foarte des în coroziunea echipamentelor casnice și industriale și în structurile subterane, datorită aerării neuniforme a oxigenului de către părțile individuale ale suprafeței metalului. Un exemplu este coroziunea unei grămezi de oțel îngropate în fundul râului (figura 7).
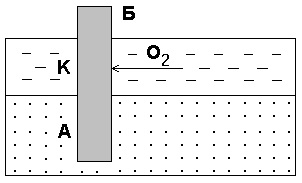
Fig. 7. Coroziunea datorată accesului neregulat la oxigen. B - grămadă; A - secțiune anodică; Regiunea K - catodă
O parte din grămadă, care este în apă, este spălată cu oxigen dizolvat în ea și va juca rolul unui catod. Solul nu este practic
conține oxigen dizolvat și acea parte a grămezii
este în ea, va fi distrusă de o anodomie.
Sarcini mecanice. Vaporii microalvanici pot să apară atunci când apar solicitări mecanice interne și externe (de exemplu, îndoirea și căderea fasciculului, suduri stramutate). Coroziunea în acest caz duce la crăparea intergranulară sau la coroziunea așa-numită "cuțit". Acest tip de coroziune provine din faptul că, pe partea întinsă a fasciculelor, legăturile interatomice sunt întinse și mai slabe decât pe partea superioară. Energia Gibbs pe această parte a fasciculului este ΔG1. Pe partea comprimată a fasciculului, energia Gibbs are mai multe valori negative ale ΔG2. Din moment ce ΔG este legat de potențialul ΔG = -nFE. apoi pe partea comprimată avem un potențial mai pozitiv E2 (catod). și pe potențialul întins - mai negativ E1 (anod).
Astfel, solicitările mecanice duc întotdeauna la apariția galvanoidelor cu EMF = E2 - E1. În același timp, dizolvarea metalului este observată în regiunea de dilatare, iar în zona de comprimare (secțiunile catodice), oxidantul (H + sau O2) este redus.
Kinetica proceselor de coroziune. Există multe exemple despre modul în care metalele mai active se dizolvă mult mai lent decât metalele mai puțin active. De exemplu, viteza de coroziune a aluminiului în condiții atmosferice este mult mai scăzută decât viteza de coroziune a fierului (-0,44 V), deși potențialul electrodului standard al aluminiului este mai negativ (-1,66 V). Acest lucru sugerează că, pe lângă influența factorilor termodinamici asupra proceselor de coroziune, este de asemenea necesar să se ia în considerare factorii cinetici, dintre care cea mai importantă este capacitatea metalelor de a trece într-o stare pasivă.
Procesul de pasivare a metalelor este asociat cu formarea pe suprafața lor a peliculelor subțiri de compuși solubili, oxizi, hidroxizi, săruri sau amestecurile lor. Aceste filme blochează suprafața și împiedică transferul de electroni și oxidanți pe suprafața metalului.
Se știe că coroziunea unui metal cu depolarizarea cu hidrogen
cu cât mai puțin supratensiunea reacției
evoluția hidrogenului (H2, B) pe acesta (a se vedea tabelul 3).
De exemplu, E ° Pb2 + / Pb = -0,126 V, adică Plumbul este instabil termodinamic în medii acide, dar metalul nu interacționează cu acizi sulfurici diluați și cu acid clorhidric, deoarece pe plumb H2 = -1,56 V.
Din același motiv, zincul (E ° (Zn 2+ / Zn) = -0,76 V) este de asemenea instabil în medii acide. Cu toate acestea, datorită supratensiunii mari a hidrogenului, aceasta elimină foarte încet hidrogenul din acizi.
In contact cu zincul de cupru (Zn | H + | Cu), hidrogen naCuvosstanovlenie iese mult mai rapid (N2 cupru na0,4 Vmenshe decât Zn). Din acest motiv, în contact cu cupru-zinc se dizolvă foarte activ, care este însoțită de o evoluție intensivă a hidrogenului pe cupru.