Caracteristici generale ale carbonului
Carbonul este al șaselea element al tabelului periodic. Denumire - C din latină "carboneum". Situat în a doua perioadă, grupul IVA. Se referă la metale nemetalice. Încărcarea nucleului este de 6.
Masa atomică și moleculară a carbonului
Masă moleculară relativă a substanței (dl) - este un număr care arată cât de multe ori mai mult 1/12 atomi de carbon în greutate masa a moleculei, și elementul relativ masa atomică (Ar) - câte ori greutatea medie a atomilor de element chimic este mai mare decât masa atomică a 1/12 carbon.
Deoarece în stare liberă carbonul există sub forma moleculelor monatomice C, valorile masei sale atomice și moleculare coincid. Ele sunt egale cu 12.0064.
Allotropia și modificările alotropice ale carbonului
Într-un carbon de stat liber există sub formă de diamant, cristalizând în cubic și hexagonal (lonsdalite) sistem și grafit, aparținând sistemului hexagonal (Fig. 1). Formele de carbon, cum ar fi cărbunele, cocsul sau funinginea, au o structură neordonată. Există, de asemenea, modificări alotrope, obținute din soiuri sintetice - carbiene și soiuri de tip polycubulene - carbon, construite din polimeri liniari de lanț, cum ar fi -C = C- sau = C = C =.
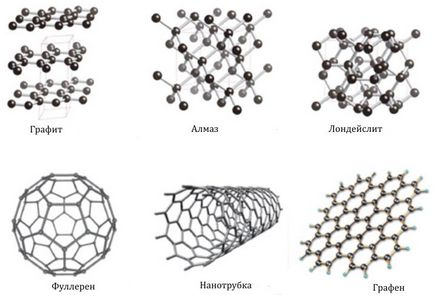
Fig. 1. Modificări alotropice ale carbonului.
De asemenea, modificări alotropice ale carbonului cunoscute, având următoarele denumiri: grafenice, Fulerena, nanotuburi, nanofibre, astral, steklouglerozh, nanotuburile colosale; carbonul amorf, nanopoturile de carbon și nanofilmele de carbon.
Izotopi de carbon
În natură, carbonul există sub forma a doi izotopi stabili 12 C (98,98%) și 13 C (1,07%). Numărul lor de masă este de 12 și respectiv 13. Nucleul atomului din izotopul de carbon 12C conține șase protoni și șase neutroni, iar izotopul 13C - același număr de protoni și cinci neutroni.
Există un izotop artificial (radioactiv) de carbon 14 cu un timp de înjumătățire de 5730 ani.
Ioni de carbon
La nivelul energiei exterioare a atomului de carbon există patru electroni care sunt valenți:
Ca rezultat al interacțiunii chimice, carbonul își poate pierde electronii de valență, i. E. să fie donatorul lor și să se transforme în ioni încărcați pozitiv sau să ia electronii unui alt atom, adică să fie acceptorul lor și să se transforme în ioni încărcați negativ:
C0-2e → C2 +;
C0-4e → C4 +;
C 0 + 4e → C 4-.
Molecule și atom de carbon
În stare liberă, carbonul există sub forma moleculelor monatomice C. Oferim câteva proprietăți care caracterizează atomul și molecula de carbon: