Potențialul de odihnă este diferența dintre potențialele electrice din interiorul și din exteriorul celulei în repaus. Valoarea PP variază în intervalul de 30-90 mV.
PP este baza excitației și procesării informațiilor de către celula nervoasă, asigură reglarea activității organelor interne și a sistemului musculo-scheletal prin declanșarea proceselor de excitație și contracție a mușchiului.
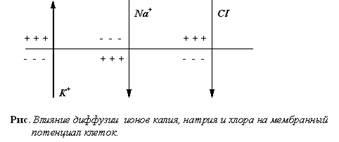
Ionul principal, care asigură formarea PP, este ionul K +. Într-o celulă de odihnă, se stabilește un echilibru dinamic între numărul de ioni K + care ies din celulă și intră în celulă. gradienti electrice și concentrare se opun reciproc, în funcție de gradientul concentrației K + caută să iasă celulele și încărcătura negativă în interiorul celulei și încărcătura pozitivă a suprafeței exterioare a membranei celulare a preveni acest lucru. Atunci când concentrația și gradienții electrice sunt echilibrate, numărul de ioni K + care părăsește celula devine egal cu numărul de ioni K + pe fiecare celulă. În acest caz, potențialul de echilibru al potasiului este stabilit pe membrana celulară.
Alți ioni participă, de asemenea, la crearea PP: Na +, Cl¯, Ca2 +.
Permeabilitatea membranei celulare în repaus pentru Na + este foarte scăzută. Na + ionii au tendința, în funcție de concentrația și gradienții electrice, să tindă și să treacă într-o mică cantitate în celulă. Aceasta duce la o scădere a PP, deoarece pe suprafața exterioară a membranei celulare, numărul total de ioni încărcați pozitiv scade și o parte din ionii negativi din celulă sunt neutralizați de ioni de Na + incarcați pozitiv care intră în celulă.
Efectul Cl¯ pe valoarea PP opusă influenței Na +. CI¯ în funcție de gradientul de concentrație, să se străduiască și să treacă în celulă. Concentrațiile de ioni K + și Cl¯ sunt aproape una de cealaltă. Dar Cl¯ este situat în principal în afara celulei și K + - în interiorul celulei. Împiedică intrarea Cl¯ celula are un gradient electric, deoarece încărcarea din interiorul celulei este negativă, ca și taxa Cl¯. Un echilibru al forțelor de gradient de concentrație care facilitează intrarea Cl¯ în celulă și un gradient electric care împiedică intrarea Cl¯ verificați modelul. Când ajunge Cl¯ în interiorul celulei, numărul de încărcări negative din afara celulei scade ușor, iar în interiorul celulei crește: Cl¯ se adaugă la anionii mari de natură proteică care se află în interiorul celulei. Astfel, Cl¯, care penetrează în celulă, crește PP.
Suprafețele interioare și exterioare ale membranei celulare poartă propriile încărcături electrice. Pierderile externe fixe externe, neutralizând încărcăturile pozitive ale suprafeței exterioare a membranei, reduc PP. Încărcările negative interne fixe ale membranei celulare, dimpotrivă, adăugând anionii în interiorul celulei, cresc PP. Ionii Ca2 + interacționează cu încărcături externe negative externe ale membranei celulare, ceea ce duce la o creștere și stabilizare a PP.
În general, PP este suma algebrică a nu numai a tuturor încărcărilor de ioni din exteriorul și în interiorul celulei, dar și a încărcărilor negative externe și interne ale suprafeței membranei celulare.
1. Potențialele membranei și natura lor ionică
Teoria membranei biopotențialelor a fost prezentată în 1902 de către Bernstein. Dar numai în anii '50 această teorie a dezvoltat într-adevăr și dovedit experimental Hodgkin, care deține ideile de bază și teorii despre gradienții rol de ioni în cazul potențialelor biologice și asupra mecanismului de distribuție a ionilor între celulă și sredoy.Suschnost această teorie constă în faptul că repaus potențial și acțiune potențială sunt potențiale ale membranei inerent cauzate proprietăți semipermeabile membranei celulare și distribuția neuniformă a ionilor între celulă și mediu, care este sprijinit mecanisme de transport activ încă localizate în membrana însăși.
1.1 Potențialul de odihnă, ecuația Nernst
Este clar că difuzia continuă numai până când se stabilește echilibrul dintre forțele câmpului electric apărut și forțele de difuzie. Dacă presupunem că potențialul de odihnă este determinat de difuzia ionilor de potasiu numai din citoplasmă spre exterior, atunci valoarea ei E poate fi găsită din ecuația Nernst:
membrană potențială electrodifuzie
unde [K] i și [K] e activitatea de ioni de potasiu în interiorul și în exteriorul celulei; F este numărul de Faroeus, T este temperatura absolută; E - schimbarea potențialului; R este constanta gazului.
7. Condiții pentru apariția PD. Legea "totală sau nimic".
PD este un proces electrofiziologic, exprimat printr-o oscilație rapidă a potențialului de odihnă al membranei datorită mișcării ionilor în și din celulă și capabilă de propagare fără amortizare.
PD asigură transmiterea semnalului între celulele nervoase, între centrele nervoase și organele de lucru, în mușchii PD asigură procesul de cuplare electromecanică.
Valoarea PD variază în intervalul 80-130 mV. AP amplitudine nu depinde de puterea de stimulare, este întotdeauna un maxim pentru o anumită celulă, în condiții specifice: PD se supune „totul sau nimic“, dar care nu fac obiectul legii de forță.
Cu un stimul mic al celulei, PD nu apare deloc sau atinge valoarea maximă dacă stimulul este prag sau super-prag.
Există trei faze ale PD:
- depolarizarea - dispariția încărcării celulare (reducerea potențialului membranei la zero)
- inversiune - schimbarea încărcării celulare în sens invers, atunci când partea interioară a membranei celulare este încărcată pozitiv, iar cea externă - negativ
- repolarizarea - restabilirea încărcării celulare inițiale, când în interiorul celulei încărcarea devine din nou negativă și în afara - încărcarea este pozitivă.
Faza de depolarizare: Sub acțiunea stimul depolarizant la o celulă (de exemplu, curent electric), depolarizarea inițială a membranei celulare are loc fără o modificare a permeabilității pentru ioni. Când depolarizarea atinge aproximativ 50% din potențialul pragului, crește permeabilitatea membranei celulare pentru Na +. Condiția oferind intrare Na + în celulă, este de a crește permeabilitatea membranei celulare, care este determinată de starea mecanismului Na-canal gating (amplasate pe laturile exterioare și interioare ale membranei celulare). Cand celulele depolarization ajunge la o valoare critică - 50 mV, permeabilitatea membranei pentru Na + crește brusc: se deschide un număr mare de canale și Na-Na + avalanșă repede în celulă. Ca rezultat al intensificării curentului Na + din interiorul celulei, procesul de depolarizare trece foarte repede. Ca urmare, PP (potențial de odihnă) dispare, devine egal cu zero. Faza de depolarizare se termină aici.
Faza inversiune: Dupa introducerea dispariția PP Na + în celulă continuă, astfel încât numărul de ioni pozitivi in celula mai mult decât numărul de ioni negativi, taxa in interiorul celulei devine pozitiv, exterior - negativ. Acum, gradientul electric împiedică intrarea Na + în celulă (sarcinile pozitive se resping reciproc), conducția Na scade. Cu toate acestea, Na + continuă să intre în celulă pentru o perioadă de timp, după cum reiese din creșterea continuă a PD. Aceasta înseamnă că gradientul de concentrație, care asigură mișcarea Na + în celulă, este mai puternic decât cel electric, ceea ce împiedică intrarea Na + în celulă. Aproximativ în intervalul 0,5-2 ms după începutul depolarizării, creșterea PD este oprită ca urmare a închiderii Na și a deschiderii canalelor K, i. E. datorită creșterii permeabilității pentru K + o creștere accentuată a randamentului său din celulă. K + este împins de o sarcină pozitivă din celulă și atras de o încărcare negativă din afara celulei. Aceasta continuă până când încărcarea pozitivă din interiorul celulei dispare complet până la sfârșitul fazei de inversare.
Faza de repolarizare se datorează faptului că permeabilitatea membranei celulare pentru K + este încă ridicată, K + continuând să părăsească rapid celula. Deoarece celula are acum o încărcătură negativă în interior și din afară este pozitivă, gradientul electric împiedică K + să părăsească celula, ceea ce îi reduce conductivitatea, deși continuă să iasă. Adesea, la sfârșitul PD, repolarizarea încetinește, ceea ce se explică prin scăderea permeabilității membranei celulare pentru K +.
Rolul principal în dezvoltarea PD este jucat de Na +, care asigură întreaga parte ascendentă a vârfului PD.
8. Refracția membranei neuronului: cauze și semnificație.
Potențialul de acțiune (PD) se poate propaga de-a lungul membranei în ambele direcții de la locul apariției sale inițiale. Dar în condiții fiziologice, PD, care apare, de exemplu, în corpul unui neuron, se extinde până la periferie de-a lungul proceselor într-o singură direcție. Propagarea inversă a PD nu apare datorită faptului că de ceva timp acea parte a membranei în care se dezvoltă PD devine inexplicabilă. Această stare de excitație a membranei se numește refractare. Lipsa excitației membranei se datorează faptului că, după excitarea anterioară, canalele de sodiu devin inactive pentru o perioadă de timp. Refractoritatea - perioada de trecere a stării membranei. Și dacă, la început, membrana este insensibilă la orice forță a stimulului, ceea ce este indicat de o perioadă refractară absolută. atunci există o perioadă relativă refractară, în timpul căreia stimularea suprataxibilă poate provoca deja apariția PD. Această perioadă este cauzată de o revenire treptată la canalele de sodiu inițiale în Propozitia atunci când sunt închise doar poarta de activare și treptat inaktivatsionnye otkryvayutsya.Prodolzhitelnost perioada refractară absolută determină frecvența maximă de generare a potențialelor de acțiune, de pescuit, care este denumit labilitate. Labilitatea diferitelor structuri excitabile nu este aceeași. Este cel mai mare în celulele nervoase și în procesele lor, cel mai mic în fibrele musculare netede. Deci, în neuron, perioada absolută refractară este de aproximativ 1 ms, prin urmare, până la 1000 imp / sec poate trece prin ea. Cu toate acestea, nu toți neuronii au o asemenea labilitate ridicată. Perioada refractară absolută este aproximativ aceeași cu durata PD.
9. Transportul ionic activ și pasiv. Rolul funcțional și mecanismul de funcționare a canalelor și pompelor ionice.
CANALE ION, molecule mari de proteine si structuri supramoleculare natura lipoprotein, incorporate in membrana celulelor si organite sale (vezi. Membrane biologice). Furnizarea de trecerea selectivă a ionilor prin membrană, inclusiv celulele în mediul extern și invers. Conform modelului propus în 1972 godu Singer și Nicholson, membranele biologice sunt structura lichid-mozaic: membrană fosfolipidică în filmul „float“ molecula de proteină lichidă. In particular, moleculele de proteine numite integrant pătrunde prin membrană, care acționează la un capăt la citoplasmă și altele - la mediul celular extern. In cadrul unei astfel de molecule de proteină are un fel de „gaură“ sau pori apoși prin care difuze iony.Transmembranny și transportul ionilor prin canale - baza fenomenelor bioelectrice din organism. Există o varietate de canale de ioni, care diferă în dispozitiv și funcțiile pe care le îndeplinesc. Numărul acestora poate varia de la câteva zeci de mii per m2 de membrană. Cel mai simplu dispozitiv în conformitate cu canalele sunt „scurgere pasiv„ion - proteină“gaură" în membrana permeabilă ionii. Ele sunt în mod constant vizibile, indiferent de acțiunea de reglementare câmp chimice sau electrice. Numărul de canale este mic. grup Considerabil mare și important constă în căile de scurgere permeabilă selectiv un tip de ioni (în principal - ioni de potasiu). gradient de concentrație Selective randament de potasiu de anioni întârzie celulele și nu pătrunde prin membrana de separare cauzează sarcină pe laturile opuse ale membranei și care formează un potențial de repaus la orice celulă. Împreună cu un mod constant deschis canale de scurgere de ioni, există alte canale de ioni pe membrana oricărei celule. Cele mai multe ori acestea sunt deschise și închise numai pentru o perioadă scurtă de timp și numai ca răspuns la o acțiune specială semnal: potentsialoaktiviruemye cunoscut (deschis numai ca răspuns la schimbările în câmpul electric prin membrana) și hemoaktiviruemye (deschisă numai ca răspuns la anumite substanțe chimice) canale. Spre deosebire de canalele de scurgere specifice fiecărei celule și implicate în formarea potențialului de repaus al celulelor potentsialoaktiviruemye canale ionice sunt prezente numai in celulele excitabile - neuroni, celule musculare, si altele. Ei sunt cei care sunt direct implicate în generarea potențialului de acțiune și de excitație canale kletki.Molekuly potentsialoaktiviruemyh au aparat sofisticat; componentele lor majore funcționale - ioni selectivi de filtrare și mecanismul de suprimare a fasciculului canalului. Filtrele selective au o gâtuire specială și grup chimic încărcat specific localizat în interiorul canalului, care permite trecerea doar un singur tip de ioni. Cunoscute canale potentsialaktiviruemye transmisive numai de sodiu, potasiu sau doar numai calciu. Mecanismul Gating - este un grup de atomi într-o moleculă de canal, un purtător de sarcină electrică și capabile deplasările locale (conformație) molecule în interiorul canalului ca răspuns la un câmp electric. grupuri, denumite „sisteme Gate“ în mișcare, în funcție de locație sau de clearance-ul se suprapun porii de ioni, care este blocat (inactivează) canal sau deschide lumenul porilor. În care cele două coexistă în canalul „poarta“ mecanism care acționează în direcția opusă. În repaus, atunci când canalul este închis, unele „poarta“ (activare) sunt închise, și inaktivatsionnye - deschis. Sub acțiunea stimul electric de stimulare (depolarizarea), ambele grupuri Gate încărcat sunt deplasate în canalul aproape simultan, dar în direcția opusă. Din moment ce poarta inaktivatsionnye mutat mai lent, primul canal reușește să activeze (deschis), și apoi - inactivat (închis). Prezența tip doi „poarta“ constând dintr-un canal permite autoreglare funcționează kanala.Hemoaktiviruemy canal de tip ionic se deschide și se trece ioni numai după interacțiunea cu reactivi adecvați chimici - hormoni, mediatori, etc. (de exemplu, acetilcolina, adrenalina, histamina) ... În acest scop, canalele au pe (citoplasmatice) suprafața sa specială exterioară sau interioară activă tsentry.Esche un tip de canale de ioni descoperite în 1980, - este canalele ionice sensibile la intindere. Ele sunt deschise și a trecut ioni ca răspuns la tensiunea membranei. S-au găsit în celule excitabile și non-excitabil. Urmărirea tulpinilor organe musculare astfel de canale joacă un rol important în menținerea activității celulelor cardiace, celulele musculare netede ale peretelui vascular și altele asemenea. D.Naryadu cu transportul pasiv al canalelor de ioni, există o clasă mare de canale de transport ionice active numite pompe ionice. pompe de ioni ioni de transfer prin membrană împotriva gradientului concentrația lor utilizând energia eliberată prin hidroliza ATP. pompe ionice Molecule - proteine transmembranare mari (greutate moleculară aproximativ 150.000) capabile de a lega și scinda ATP. De exemplu, pompa de conjugat sodiu potasiu efectuează transferul de sodiu și potasiu - în celulă. Pe parcursul acestei 1 secunde pompa 200 transporta ionii de Na + de 130 celule și K + ioni în celulă. Răspândită bine pompa si Ca 2+ (ATPase de calciu) scavenge ionii de calciu în exces din celula. Sistemul de ioni de transport activ, asigurând concentrații constanța anumitor ioni în celule joacă un rol crucial în menținerea nivelului de potențial de repaus de celule.
11. Tipuri de receptori pentru mediatori. Conceptul de agoniști și antagoniști.
(Mediator mediator latin: sinonim pentru neurotransmițători)
substanțe bioactive secretate de terminații nervoase și transmiterea condițional impulsurilor nervoase la sinapse. Ca M poate servi o varietate de substanțe. Există aproximativ 30 de tipuri de mediatori, dar numai șapte dintre ele (acetilcolina, noradrenalina, dopamina, serotonina, acid gamma-aminobutiric, glicină și acid glutamic), de obicei denumite neurotransmitatori „clasice“.
M. Implicarea în transmiterea impulsurilor nervoase este după cum urmează. Specializat pentru celula presinaptice secretia porțiune M. are o așa-numita membrana exterioara secretorie speciala care la membrana de excitație celulară presinaptică formează o veziculă care conține M. conținutul fiolei apoi turnat în fanta sinaptică, dispersează la membrana postsinaptică, unde interacționează cu receptorii specifici. Studiind actiunea M asupra receptorilor organelor periferice și ts.ns Receptorii a relevat diferite tipuri de receptori pentru același mediator (m-, n-colinergic, # 945; -, # 946; receptorilor adrenergici, etc.) .. Separarea lor se bazează pe caracteristicile de reacții biochimice în sistemul neurotransmitator - receptor. De exemplu, în reacția m-receptor este caracterul muskarinopodobny (nu sunt sensibili la curara otravă), n-receptori - nikotinopodobny (sensibili la curara otravă). Interacțiunea cu mediatori # 945; -receptorii determină efectul excitației (îngustarea vaselor, contracția uterului etc.): cu - receptori - efecte inhibitoare (vasodilatație, relaxare a bronhiilor). În același timp # 945; - și Receptori localizați în diferite organe, pot reacționa diferit la mediatori. În funcție de natura interacțiunii # 945; - și Receptori cu diferiți M. acești receptori sunt, respectiv, divizați în # 945; 1-, # 945; 2 -, # 946; 1- și # 2-adrenoreceptorii.