Să notăm principalele puncte ale acestei teorii.
1. Adsorbția este monomoleculară.
2. În timpul adsorbției, se stabilește un echilibru dinamic, care poate fi considerat ca fiind quasi-chimic. În condiții de echilibru, vitezele proceselor de adsorbție și de desorbție sunt egale.
Constanta echilibrului de adsorbtie
unde cad este rata de adsorbție constantă; cde este rata constantă a desorbției.
Trecând de la această teorie, a fost derivată o ecuație, pe care o oferim fără deducere:
unde este adsorbția maximă a agenților tensioactivi; Γ - adsorbția la o concentrație de c; K este constanta de echilibru a adsorbției.
Dependența adsorbției asupra concentrației este prezentată în figura 3.7.
Trei secțiuni sunt clar vizibile pe curbă:
Segmentul meu este o linie dreaptă pornind de la origine. De fapt, din ecuația Langmuir (3.15) pentru concentrațiile mici Kc <<1,1 + Кс 1 и .
A treia secțiune corespunde unei linii drepte paralele cu axa absciselor, ceea ce înseamnă că adsorbția a atins valoarea limită. În acest caz, Kc >> 1 și 1 + Kc Kc. Prin urmare,
Secțiunea II corespunde părții curbilinere a graficului și este descrisă de ecuația completă Langmuir (3.15).
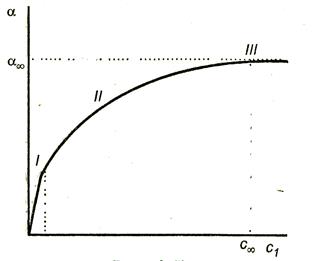
Figura 3.7. Dependența adsorbției de concentrația surfactanților.
Pentru a găsi constante în ecuația Langmuir, ar trebui redusă la o formă liniară. Pentru a face acest lucru, partea dreaptă și cea stângă a ecuației trebuie să fie "întoarse":
Înmulțim ambele părți ale ecuației (3.16) cu c:
În Fig. 3.8. graficul este afișat.
Tangenta pantei liniei la abscisa
Segmentul, tăiat de o linie dreaptă pe axa y,
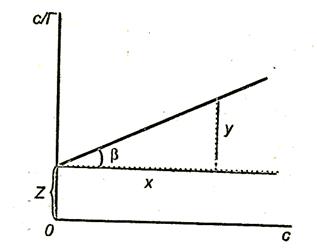
Figura 3.8. Dependența valorii c / T de concentrația surfactanților.
Se demonstrează că în ecuația Shishkovsky (constanta capilară specifică) și K în ecuația Langmuir (constanta echilibrului de adsorbție), aceasta este aceeași cantitate.
După construirea programului. se poate găsi adsorbția limitativă și echilibrul de adsorbție constant K.
Deoarece adsorbția este privită ca o reacție pseudo-chimică, pe baza termodinamicii chimice se poate scrie
Shishkovsky a stabilit empiric că K crește constant cu un factor de 3,5 până la 3,5 atunci când lanțul este extins de o legătură -CH2.
Noi scriem expresia pentru diferența în activitatea de adsorbție a doi termeni învecinați ai seriilor de omologie.
= 8,31 * 298 * În 3,5 ± 3,2 kJ / mol,
unde n este numărul de atomi de carbon din radicalul hidrocarbonat.
Aceasta înseamnă că pentru a transfera fiecare grupă CH2 de la stratul de suprafață la faza în vrac, este necesar să se cheltuiască 3,2 kJ / mol de energie. Aceasta este lucrarea de extindere a dipolilor de apă cu cantitatea de grup volum -CH2 - valoarea aditivului și aceeași pentru diferite serii de compuși de limită alifatică. Diferența constantă în activitatea de adsorbție pentru doi termeni învecinați se transformă într-un raport constant (3-5), care apare în regula Duclos-Traube. Esența acestei reguli, prin urmare, este că activitatea de adsorbție pe fiecare grupă - CH2 este constantă, aproape de 3,5 kJ / mol.
În concluzie, observăm că în plus față de ecuațiile lui Gibbs, Shishkovsky și Langmuir, există ecuația Frumkin, care face posibilă calcularea modificării tensiunii de suprafață ca urmare a adsorbției: