Ce este peroxidul de hidrogen din punctul de vedere al unui chimist
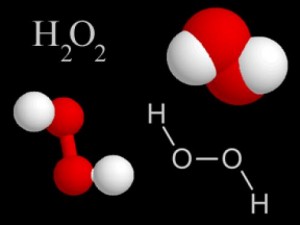
Peroxidul de hidrogen este o rudă foarte apropiată de apă și, în formula sa chimică, diferă de ea doar de un atom de oxigen suplimentar - H2O2. Dar acest atom extra dă proprietăți peroxidului, foarte diferit de apa obișnuită.
Dacă vă uitați la formula structurală a peroxidului de hidrogen, vom vedea că doi atomi de oxigen sunt conectați direct unul la celălalt. Această legătură este extrem de fragilă, prin urmare molecula de peroxid este instabilă. Un peroxid de hidrogen pur, nediluat, este capabil să se descompună în apă și oxigen cu o explozie. În soluțiile apoase diluate este mult mai stabilă.
Molecula peroxidului de hidrogen nu este o secvență liniară a atomilor de hidrogen și oxigen. Legăturile dintre atomii de hidrogen și oxigen sunt localizate în unghi drept față de legătura dintre atomii de oxigen și în mai multe variante. Din punct de vedere grafic, molecula de peroxid poate fi reprezentată după cum urmează:
Această structură a moleculei de peroxid de hidrogen determină instabilitatea sa, care este utilizată atât în industrie, cât și în medicină. Ca urmare a ruperii legăturilor dintre atomi, peroxidul de hidrogen se rupe în apă și oxigen. Anumiți compuși ai metalelor (de exemplu, cupru, fier, mangan), acționează drept catalizatori, adică să promoveze rapid descompunerea peroxidului de hidrogen, chiar și în cantități foarte mici. Prin urmare, atunci când se stochează peroxidul pentru a preveni decăderea acestuia (ceea ce se întâmplă cu explozia), se adaugă substanțe stabilizatoare.
Ca și relația chimică cea mai apropiată a apei, peroxidul de hidrogen dizolvă multe săruri, cu apă (și, de asemenea, cu alcool) se amestecă în orice proporție. Trebuie remarcat faptul că mediul acid împiedică descompunerea peroxidului de hidrogen, cu toate acestea, din nou, atunci când depozitarea unor cantități mari de peroxid sale se acidulează cu acid sulfuric sau acid fosforic (desigur, acest lucru se aplică numai pentru utilizarea industrială a peroxidului).
Când este încălzit sau expus la descompunerea luminii peroxidului este îmbunătățită pentru stocarea sticla cu acestea (de obicei, farmaciile acum peroxidul vândute în sticle din plastic transparent), de preferință într-un loc răcoros întuneric.
Peroxidul de hidrogen diferă de apă și de proprietățile sale fizice. Punctul de îngheț este aproape de apă, la 0,5 ° C peroxidul se transformă în gheață. În plus, spre deosebire de apă, este comprimat, nu este extins. Când se îngheață se formează cristale albe și după dezghețare, peroxidul nu-și pierde proprietățile. Peroxidul se fierbe la o temperatură de 67 ° C.
Peroxidul de hidrogen este un oxidant foarte puternic, adică dă cu ușurință oxigenului său (comparativ cu compusul mai stabil - apă). Deci, dacă picătură un peroxid pur sau de mare concentrare pe hârtie, rumeguș sau alte materiale combustibile, se aprind (amintiți-vă că focul - este energia eliberată prin oxidarea). Această proprietate - un grad ridicat de oxidare - determină aplicarea pe scară largă a peroxidului, în primul rând în industrie. Majoritatea peroxidului produs pe an (mai mult de 100 mii tone) este utilizat în industria chimică și în energie. Schematic, formula pentru descompunerea oxidativă a peroxidului de hidrogen poate fi reprezentată după cum urmează:
H2O2 = H2O + O- (pentru oxidare).
O astfel de formulă este caracteristică unui mediu acid. Într-un mediu alcalin, formula ar arăta astfel:
H2O2 = O2 + 2H + (pentru reducere).
Cea mai simplă modalitate de a produce peroxid de hidrogen este de a acționa cu peroxid de bariu (BaO2) cu acid sulfuric diluat. Ca rezultat, se formează peroxid și o sare insolubilă în apă, care este îndepărtată prin filtrare. Dar cea mai mare parte a peroxidului este obținută prin interacțiunea cu apă a acidului persulfuric (H2S2O8) sau a unor săruri ale acestuia.
Forme de producere a peroxidului de hidrogen
Soluția concentrată de peroxid de hidrogen - perhidrol - conține până la 35% peroxid. Pentru a prepara soluții medicinale, trebuie diluat de 10 ori. Deși în America, de exemplu, soluția concentrată de peroxid de hidrogen este mai populară. O astfel de soluție trece într-un test în cadrul Comitetului pentru controlul produselor alimentare și se distinge prin absența impurităților, așa că el este cel care este preferat (cu o diluție adecvată) de către medici americani care utilizează peroxid în tratamentul bolilor.
În farmacie puteți cumpăra peroxid de hidrogen și sub formă uscată, sub formă de tablete, numite hidropirite. Hidropiritul conține aproximativ 35% peroxid și pentru a prepara o soluție de 3%, trebuie să dizolvați un comprimat într-o lingură de apă.
Încă o dată vă reamintesc că peroxidul de hidrogen trebuie depozitat într-un loc răcoros, evitând impactul luminii. Și asigurați-vă că departe de copii - nediluat peroxid pe piele, și mai ales pentru a mucoase poate provoca arsuri, și chiar mai periculos dacă copilul glotnet acest instrument - din cauza peroxidului în aparență imposibil de distins de apă.
Peroxidul de hidrogen în natură
Peroxidul de hidrogen nu este un compus artificial, care poate fi obținut numai prin reacții chimice în laborator. Natura din jurul nostru conține acest compus în cantități considerabile. Peroxidul este conținut în apa de ploaie și în zăpadă, unde este format din ozon atmosferic, în aerul montan. Turiștii care călătoresc în munți știu că este mai bine să bea apă din curenții în care apa este albă din numeroase bule de oxigen. Dar, desigur, nimeni nu își dă seama că o mare parte din culoarea albă se datorează prezenței unui astfel de apă de peroxid de hidrogen format în apă, datorită aerării sale îmbunătățite. În astfel de apă, cantitatea de microbi și paraziți dăunători este extrem de mică, o astfel de apă poate fi beată fără fierbere suplimentară sau tratare cu preparate speciale. Bineînțeles, acest lucru se aplică acestor râuri și fluxuri care nu au fost grav persoana care nu apa reziduală coborâtă orice fabrici din jur contaminate - împotriva contaminării chimice cu săruri de metale grele sau substanțe toxice, peroxid de hidrogen este lipsit de putere.
De altfel, o simpla scuturare a sticlei cu apă și, prin urmare, saturarea apei cu oxigen duce la formarea unor peroxid de hidrogen și, în consecință, îmbunătățește puritatea apei, gustul său.
Oamenii de stiinta au descoperit ca apele sursei Lourdes din Franta, cunoscute pentru proprietatile lor uimitoare de vindecare, contin o cantitate semnificativa de peroxid de hidrogen natural. Cum merge acolo? Da, toți cu aceeași zăpadă. Apa sursă se formează ca rezultat al topirii zăpezii la altitudine mare în munți. În drum spre pământ, zăpada adsorbtează o cantitate mare de ozon (este o moleculă de oxigen triatomic, extrem de instabilă) în straturile superioare ale atmosferei. Nimeni nu se implică în mod special în alte izvoare de vindecare montană, dar cel mai probabil există peroxid de hidrogen acolo.
Peroxidul de hidrogen se găsește în legume și fructe proaspete care nu au fost gătite. Încălzirea, fierberea, prăjirea distrug cea mai mare parte a oxigenului, deci deși legumele fierte și conțin anumite vitamine, de fapt ele sunt "moarte". Același lucru se aplică sucurilor de fructe proaspete - sunt bogate în oxigen, datorită capacității lor de a purifica corpul și de a-l satura cu forțe vitale. Aceste sucuri sunt vândute în magazine, este foarte departe de proaspete - de obicei concentrate recuperate, uneori, îmbogățit în mod artificial, dar în termeni de saturație cu oxigen - absolut produse goale.
Una dintre cele mai progresive metode de purificare a apei este ozonarea sa combinată cu iradierea ultravioletă. În acest caz, peroxidul de hidrogen și oxigenul liber se formează în apă, care, de asemenea, ucide microflora patogenă. Această metodă este mult mai sigură decât clorinarea ucigașă a apei, ca urmare a pierderii microbilor, dar că apa nu devine mai sănătoasă.
Apropo, este bine să citez dintr-o scrisoare pe care am primit-o.
Alo Întotdeauna am fost interesat de modalități netradiționale de recuperare, așa că, când m-am familiarizat cu materialele privind acțiunea terapeutică și antimicrobiană a peroxidului de hidrogen, am decis să încerc eu singur. Dacă peroxidul de hidrogen ucide microbii dăunători, de ce să nu încercați să-l utilizați pentru a dezinfecta apa. Adevărul este că de mulți ani m-am angajat în turism și adesea merg în locuri unde puritatea apei ridică îndoieli. O apă de fierbere nu are întotdeauna ocazia. Anterior, pentru dezinfecția apei în cazuri extreme, a folosit permanganat de potasiu, dar totuși este un fel de chimie. Dar de mai mulți ani am folosit o metodă diferită. Am un balon de peroxid de hidrogen cu mine. Dacă aveți nevoie pentru a colecta apă, un litru de apă de la sursa open picură 10 picături de peroxid, apoi agitați sticla și după 10 minute beau. Desigur, nu folosesc apă noroioasă, noroioasă, dar chiar și apa pură din lac conține milioane de bacterii și, așa înțeleg, îi ucide. Și în acești câțiva ani n-am avut nici o problemă din cauza apei - fără supărare scaunului, să nu mai vorbim de dizenterie.
Utilizarea peroxidului de hidrogen în viața cotidiană și în industrie
În mod natural, o astfel de substanță, ieftină și cu proprietăți unice de oxidare, găsește cea mai largă aplicație. Și medicina consumă cote nesemnificative din toate peroxidul de hidrogen produs. Și mai mult de jumătate din cantitatea de peroxid de hidrogen produs este folosită pentru albirea diferitelor materiale. Pentru aceasta se utilizează soluții apoase de H2O2 foarte diluate (0,1-1%).
Peroxidul de hidrogen are avantaje importante față de ceilalți oxidanți. Acțiunea sa este mult mai moale, în timp ce materialul albite în sine nu este afectat. Dar, probabil, principalul avantaj este inofensivitatea unei astfel de înălbire a mediului. Oxidarea prin înălbire nu dă astfel de emisii nocive în atmosferă și nu poluează atât corpurile de apă din jur, cum ar fi albirea clorului. In cele mai avansate fabricile de celuloză, de exemplu, am abandonat utilizarea compușilor cu clor, și este imediat redus daune mediului. Aș vrea să ofer sfaturi și gospodine. Astfel de substanțe de înălbire a clorului populare, desigur, sunt eficiente, dar distrug țesutul și nu sunt sigure pentru sănătate. Acum, pe piață au apărut pulberi de oxigen și lichide pentru înălbirea lenjeriei, dar este posibil să se utilizeze și tablete de hidropirite. Țesătura va dura mai mult și hainele nu vor mirosi clorul.
Cu proprietatea peroxidului de hidrogen, oxidarea coloranților este asociată cu utilizarea în arta coafurii. Mulțumită hydropyritei, multe doamne au reușit să obțină visul prețuit de a deveni o blondă. Și, deși au apărut multe coloranți, peroxidul de hidrogen rămâne cel mai ieftin și mai eficient mijloc de albire a părului.
Foarte concentrat (80% și mai mare), se folosesc soluții apoase de H2O2 ca surse de energie și în mod independent (folosind catalizatori de descompunere rapidă a H2O2 de la 1 litru de peroxid de hidrogen lichid poate produce aproximativ 5000 litri încălzit la 700 ° C un amestec de oxigen și vapori de apă) și ca oxidant al combustibilului cu jet. Peroxidul de hidrogen este folosit ca oxidant în industria chimică ca materie primă de pornire pentru compușii peroxidici, în fabricarea polimerilor, în fabricarea unor articole poroase, vinuri de îmbătrânire artificială.
Cartea de Douglas W. a spus că, prin utilizarea peroxidului de hidrogen poate fi transformat în hrană pentru animale valoroase acum paie inutile, blaturi deșeuri vegetale și alte culturi. Pentru a face acest lucru, pur și simplu, înmuiați acest "gunoi" timp de câteva ore în peroxid de hidrogen. Acest efect mărește valoarea nutritivă a furajului și îmbunătățește digestia.
Peroxidul de hidrogen este util în țară, și nu numai ca un mijloc de la un cabinet de medicamente pentru tratamentul rănilor. Există informații că plantele cresc mai bine dacă sunt udate cu o soluție slabă de peroxid de hidrogen (25 g dintr-o soluție de peroxid de 3% pe 1 litru de apă). Aceeași soluție poate fi pulverizată cu frunze de plante pentru prevenirea bolilor. Semințele de plante germinează mai bine și germenii arată mai sănătoși dacă sunt în prealabil îmbibați într-o soluție apoasă de peroxid (25 g peroxid 3% pe 0,5 litri de apă). Această metodă înlocuiește înmuierea obișnuită într-o soluție de permanganat de potasiu. Apropo, actiunea sa se bazeaza si pe faptul ca produce un atom de oxigen suplimentar. Prăjirea arborilor bolnavi cu apă peroxid (1 parte peroxid la 32 de părți apă) va ajuta să scapi de boală.
Din nou, în cartea lui W. Douglas, a existat o astfel de aplicare a peroxidului de hidrogen 3%. Faptul este că agentul cauzal al multor infecții intestinale sunt bacteriile care se găsesc pe suprafața peștilor, în special fluviale. Acum, aproape de locuire umană nu este dificil de a găsi produse contaminate cu funcțiile vitale ale iazuri și apă tulbure creează un mediu confortabil pentru microorganisme sedimentate de pe scalele și pielea de pește. Dacă peștele nu este doar spălat, ci tratat cu o soluție de peroxid de hidrogen, riscul de prindere a infecției intestinale scade de mai multe ori.
Cred că, în timp, lista de utilizare non-medicală de peroxid de hidrogen va fi extins și, probabil, va peroxidul vreodată poate înlocui petrol și gaze ca sursă sigură și ecologică a energiei. Cine știe, în cele din urmă, mai devreme sau mai târziu, omenirea își dă seama că o astfel de gestionare a naturii neînfrânate va aduce întregul Pământ în mormânt.