Expresia matematică a primei legi a termodinamicii
Legea afirmă că într-un sistem izolat suma tuturor tipurilor de energie este o constantă.
Luând în considerare acest lucru, expresia matematică a primei legi a termodinamicii în forma diferențială pentru 1 kg de fluid de lucru este scrisă în următoarea formă:
unde q este căldura furnizată fluidului de lucru, u este energia internă a fluidului de lucru, l este lucrarea de expansiune.
Deoarece lucrarea elementară din partea dreaptă a expresiei matematice a primei legi a termodinamicii este o diferență incompletă, atunci căldura elementară din partea stângă nu poate fi, de asemenea, o diferență completă a parametrilor de stare. Prin urmare, căldura elementară în termodinamică este de asemenea acceptată ca unitatea elementară de lucru cu simbolul # 948;.
După integrare, obținem următoarea expresie:
Aici pentru căldură, precum și pentru muncă, indiciile 1,2 înseamnă că căldura este, de asemenea, o funcție a procesului.
Prima lege a termodinamicii citește astfel: energia transferată corpului de lucru sub formă de căldură este cheltuită pe schimbarea energiei interne specifice a corpului și pe performanța acestei lucrări corporale.
Având în vedere acest lucru # 948; L = P dv. pot fi scrise:
# 948; q = du + P dv, [J / kg].
Prima formă a ecuației diferențiale din prima lege a termodinamicii pentru un kg de fluid de lucru este folosită în sisteme închise: cilindri de motor cu combustie internă, compresor cu piston.
Există mai multe formulări din prima lege a termodinamicii:
1. Energia nu provine din "nimic" și nu este distrusă în "nimic". Energia termică sau mecanică nu poate apărea din nimic sau nu poate deveni nimic.
2. Orice formă de mișcare este capabilă și ar trebui transformată în orice altă formă de energie. Ele pot fi reciproc reciproc numai în cantități echivalente.
3. Mișcarea perpetuă a primului tip este imposibilă (adică este imposibil să se producă lucruri din "nimic").
În 1755, Academia Franceză de Științe a anunțat că nu va mai accepta modelele mașinilor cu mișcare perpetuă.
Cantitatea mare de energie termică a procesului de alimentare cu energie termică se realizează pentru diferite fluide de lucru în sisteme deschise la presiune constantă (în cazane de abur, camere de combustie ale turbinelor cu gaz și a motoarelor cu reacție, schimbătoare de căldură), precum și o serie de procese în tehnologia chimică și multe altele. În secolul al XIX-lea, fizicianul Gibbs a introdus o funcție pentru calculele termice, care mai târziu a fost numită entalpie. Entalpia este folosit mai des decât energia internă, din acest motiv, în tabelele de proprietăți termodinamice entalpie sunt de multe ori, dar nu energia internă. Entalpie notat cu litera I (sau, ocazional, H) și reprezintă suma U energie internă a sistemului și presiunea p sistemului asupra produsului volumul său V:
Deoarece cantitățile din ea sunt funcții ale statului, atunci, ca și energia internă, entalpia este o funcție a statului. Pe lângă energia internă, munca și căldura, se măsoară în jouli (J).
Enalpia specifică este notată cu i (sau h), adică poate fi scrisă
i = u + p • v. [kJ / kg] (3)
Produsul p • v este lucrarea care trebuie folosită pentru a introduce un gaz de volum v în mediu cu o presiune P, adică P • v este energia potențială a gazului.
DiferenŃăm (3): di = du + P dv + v dP și luând în considerare acest lucru
# 948; q = du + p; dv,
di = # 948; q + v · dP, (4)
Astfel, entalpia specifică este mai mare decât intrarea externă a căldurii cu cantitatea de lucru v • dP.
Expresia (4) este adesea scrisă:
Q = di - v · dP, (5)
Expresia (5) este cea de-a doua formă de înregistrare a primei legi a termodinamicii.
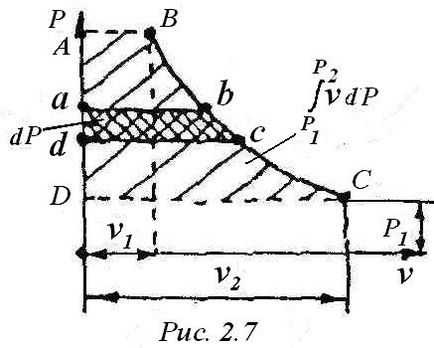
Valoarea v • dP de lucru pe grafic (Figura 2.7) este zona AB cu da .Din (3), că cei doi termeni pe total diferențialele corecte, prin urmare, și de asemenea I- entalpie diferențială completă - funcția de stat. Prin urmare, după integrarea expresiei (4), avem:
Entalpia socotiŃi de la zero, pentru care valoarea sa este luată la o temperatură de 0,01 ° C și presiunea P = 610.8 Pa, iar pentru gaze ideale la O ° C, este o funcție a presiunii. Deoarece între entalpie și energia internă există relația de mai sus, alegerea originii unuia dintre ele nu este arbitrară: punctul luat ca originea energiei interne, u = 0, i = o pv. De aceea, de exemplu, pentru apă la t = 0,01 ° C și P = 610.8 Pa = 0 și i = pv = 610.8 # 8729; 0,001 = 0,611 J / kg.
Diferența de entalpie este
unde cp este capacitatea reală de căldură în masă la presiune constantă și T este temperatura fluidului de lucru.
În calculele practice, precum și pentru energia internă, se determină creșterea entalpiei
unde capacitatea medie de căldură la presiune constantă în intervalul de temperatură t1 și t2.
Dimensiunile energiei interne și entalpiei fluidului de lucru sunt aceleași cu cele ale căldurii și a lucrului - J sau când se referă la un kg de fluid de lucru - J / kg.