Elemente ale fizicii cuantice ale atomilor și moleculelor
Teoria atomului de hidrogen din Bohr
§1 Modelul atomului Thomson și Rutherford
Doctrina structurii atomice a materiei a apărut în cele mai vechi timpuri. Cu toate acestea, până la sfârșitul secolului al XIX-lea, atomul a fost considerat elementar indivizibil ("cărămidă") de orice substanță.
La mijlocul secolului al XIX-lea, s-a dovedit experimental că electronul este una dintre componentele principale ale oricărei substanțe. (În 1749, Benjamin Franklin a emis ipoteza că energia electrică este un fel de rol central substanță materială a materiei electrice, el a atribuit reprezentarea structurii atomice a fluidului electric în lucrările lui Franklin termeni apărut pentru prima dată: .. Charge, descărcarea de gestiune, sarcină pozitivă, sarcină negativă, o baterie de condensatoare , particule de energie electrică.
Johann Ritter în 1801 a exprimat ideea unei structuri discrete, granulare de energie electrică.
Wilhelm Weber, în lucrările sale din 1846, introduce conceptul de atom de energie electrică și ipoteza că mișcarea acestuia în jurul miezului materialului poate explica fenomenele termice și ușoare.
- În 1905, JJ Thomson (Lord Kelvin) a propus primul model al atomului, conform căruia atomul este o sferă de rază încărcată continuu de o sarcină pozitivă
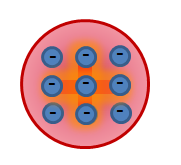
10 - 10 m, în care electronii oscilează în apropierea pozițiilor lor de echilibru. Încărcarea negativă totală a electronilor este egală cu sarcina pozitivă a mingii, deci atomul ca întreg este neutru (modelul atomului Thomson este numit "stafide" sau "budincă cu stafide").
- Modelul atomului Rutherford
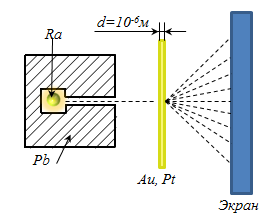
Rutherford în 1909 a efectuat experimente pe trecerea α - particulelor prin plăci metalice subțiri de aur și platină. (A-particule apar atunci când transformările radioactive Încãrcaþi α - particule este două sarcini de electroni :. Qα mase = 2 e = 2 x 1,6 x 10 -19 greutate CI patru protoni mα = 4 mp = 4 · 1,67 · .. 10 -27 kg). α - particule emise de radiu, plasate în interiorul cavității cu canalul de plumb, astfel încât toate particulele se deplasează de-a lungul canalului, în plus, să fie absorbită de plumb. Un fascicul îngust a lovit o folie de aur perpendiculară pe suprafața sa. α - particule ce au trecut prin folie și flash-ul împrăștiat cauzate de acesta (de scintilație) pe un ecran fluorescent.
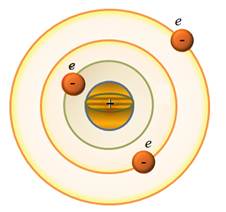
Dezavantaje ale modelului lui E. Rutherford:
a) Electronii într-un model atomic nu pot fi fixați, deoarece sub influența forței Coulomb, ei ar fi atrasi (și "căzuți") la nucleu. În acest model există nenumărate valori ale razei orburilor electronice și ale vitezelor corespunzătoare
Rezultă că raza și viteza se pot schimba continuu. În consecință, orice porțiune de energie poate fi emisă și, în consecință, spectrul atomului trebuie să fie continuu. În realitate, totuși, experiența arată că atomii au spectre de linie.
b) Pentru r ≈10-10 m v ≈ 10 6 m / s și Conform electrodynamicii, electronii care se deplasează cu accelerația trebuie să emită unde electromagnetice și în consecință să piardă energia în mod continuu. Apoi, electronul se va apropia de nucleu într-o spirală, iar după ce ≈ 10 -10 s se încadrează pe ea. Pe de altă parte, frecvența radiațiilor trebuie să se schimbe continuu datorită schimbărilor în r, v, T. În consecință, atomul va da un spectru continuu.
Încercările de a construi un model atomic folosind legile mecanicii clasice, electricității și opticii au condus la o contradicție cu datele experimentale:
model - a) instabilitatea atomului; b) spectrul continuu;
experiment - a) atomul este stabil; b) emite în anumite condiții; c) spectrul de frecvențe.
§2 Spectrul de linie al atomului de hidrogen.
Formula Balmer-Rydberg
Gazele strălucitoare dau spectre de emisii de emisii de linii care constau în linii spectrale separate. Când lumina trece prin gaze, apar spectre de linie de absorbție - fiecare atom absoarbe acele linii spectrale pe care el însuși le poate emite.
Spectrum - un set de componente armonice sau lungimi de undă. De exemplu, dacă o undă poate fi reprezentată ca o suprapunere a două valuri cu frecvențe ω1 și ω2. atunci se spune că spectrul are două componente sau două linii cu λ1 și λ2. Spectrele sunt:
a) determinată - pentru atomi și molecule simple de gaze evacuate; - molecule complexe; solide și lichide încălzite solid;
b) emisie - cu descărcare electrică de gaze, cu încălzirea solidelor etc .; absorbția - lumina trece prin gaze, lichide și solide și fiecare atom absoarbe acele linii spectrale pe care ea însăși le poate emite;
c) dispersia (prismatică) - se obțin prin descompunerea luminii albe pe prisma; difracție - atunci când este descompusă pe o rețea de difracție;
d) atomic - spectrul obținut pe atomi (de exemplu, descărcarea gazelor); moleculară (dungată) - are forma unor benzi formate din linii spectrale apropiate
1) vibrational -> DIC (regiune cu infraroșu lung λ = 0,1 ÷ 1 mm);
2) rotativ -> IR λ = 1 ÷ 10 μm;
3) vibrații electronice (spectrul vizibil și UV spectral λ = 0,3 μm și mai sus);
Primul care studiază spectrul celui mai simplu element - atomul de hidrogen. Balmer în 1885 a constatat că lungimile de undă ale celor nouă linii cunoscute de spectru de hidrogen pot fi calculate din formula
I. Ridberg (om de știință suedez) a propus o altă formă de înregistrare
- formula Balmer-Rydberg.
R '= 10973731 m -1 este constanta Rydberg (R' = 1,1 · 10 7 m -1),
deoarece , atunci putem scrie
unde R = R'c = 3,29 · 10 15 s -1 este aceeași constantă Rydberg.
Formula Balmer-Rydberg a subliniat mai întâi rolul special al întregilor în legile spectrale.
În prezent, sunt cunoscute un număr mare de linii spectrale de hidrogen a căror lungime de undă satisface formula Balmer-Rydberg cu un grad ridicat de precizie. Se poate observa din formula lui Balmer-Rydberg că liniile spectrale diferă în diferite valori ale lui n. formează un grup sau o serie de linii numite seria Balmer. Cu creșterea n, liniile spectrale ale seriei se apropie reciproc.
Seria lui Balmer este situată în partea vizibilă a spectrului, așa că a fost descoperită mai întâi.
La începutul secolului XX, în spectrul atomului de hidrogen s-au găsit mai multe serii în părțile invizibile ale spectrului.
Astfel, următoarele serii ale spectrului atomului de hidrogen