Reacția oferind conductivitatea în lanțul interior
Reacțiile la anod și catod
A) Zn - 2e = Zn + 2. K) Cu + 2 + 2e = Cu.
forța electromotoare a celulei electrochimice (forță electromotoare) este diferența de potențial de electrod ale celor două jumătăți de celule.
De exemplu, pentru elementul Daniel Jacobi
În general, forța electromotoare (emf) a celulei este dată de
electrod de referință 3 hidrogen. seria electrochimica
Valorile absolute ale potențialelor de electrod nu este cunoscut în prezent, cu toate acestea, în practică, folosind valori relative.
„Electrodul de hidrogen“ a fost selectat ca electrodul de referință. Aparatul a acestui electrod este prezentat în figura 9.2.
Figura 9.2 Schema electrod de hidrogen electrod de hidrogen - o placă de platină imersat într-o soluție de acid sulfuric 1M. Când hidrogenul molecular este trecut printr-o soluție de ea este adsorbit pe un electrod de platină, în care atomizarea apare. Ca rezultat, între hidrogen pe placă și în soluție un echilibru: H + + e «H (z) și un potențial salt # 966; .
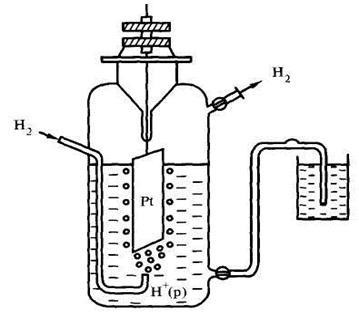
Pentru a obține rezultate comparabile de măsurare efectuate în următoarele condiții standard: T = 298 K, P = 1 atm. C (sare) = 1 mol / l.
Potențialul electrodului este măsurat în volți (V). Pentru un potențial standard de electrod de hidrogen convențional considerat ca fiind zero.
În conformitate cu scăderea proprietăților de regenerare a metalelor sunt aranjate în următoarea secvență electrochimice:
Li Na Mg K AI Ti Mn Zn Fe Pb H Bi Cu Ag Pt Au.
In seria electrochimică sunt aranjate în partea stângă a potențialelor de electrod standard de hidrogen de metale care au o valoare negativă, iar dreptul hidrogenului - metale ale căror electrod standard de potentiale sunt valori pozitive.
4 ecuația Nernst
În cazul în care condițiile diferă de standard, valoarea potențialului electrodului este calculat prin ecuația Nernst.
în care R - este constanta universală a gazelor (8.31 J / mol · K),