Obiectiv: să se familiarizeze cu procesele de material de tranziție de fază, cu conceptul de căldura de vaporizare și proprietățile sale; tehnica maestru studiu experimental al curbei de saturație a vaporilor de apă.
procesele de tranziție de fază
Faza de tranziție se numește trecerea materiei de la o etapă la alta. Unul și același material în funcție de condițiile externe (de presiune și temperatură) pot fi în diferite stări de agregare.
Substanța în diferite stări de agregare are proprietăți fizice diferite și, în special densitate. Această diferență se explică prin natura interacțiunilor intermoleculare.
Tranziția de fază din faza solidă în care apar gazoase la presiuni foarte scăzute, numit sublimare. Căldură de sublimare este mai mare decât căldura topiturii împăcării și căldura de vaporizare.
Când tranziția de fază este, de obicei, se schimbă brusc densitatea de substanță. În cazurile de vaporizarea și sublimarea densitatea fazei gazoase este întotdeauna mai mică decât densitatea fazei condensate. Ca topire, aici pentru diferite substanțe diferite cazuri sunt posibile: densitatea fazei solide poate fi fie mai mare sau mai mică decât densitatea lichidului.
Următoarele faze de clasificare puncte de tranziție: tranziție punct lichid - vapori de numitul punct de fierbere (care este de asemenea, punctul-TION condensator), punctul de tranziție solid - lichid - punct de topire (punctul de solidificare este același), iar punctul de tranziție solid-vapori - punct de sublimare.
La tranziția de fază a curbei în stare -diagram pT-accident vascular cerebral, în care cele trei faze coexistă, fig zitsya punctul (așa-numitul punct triplu). Cel mai caracteristic pentru substanța pură este un punct triplu unde coexistă solid, evreu-kai și faze de vapori. Pentru punctul triplu al apei corespunde temperaturii de 0,01 ° C și o presiune de 611.7 Pa (0.0062 kg / cm2).
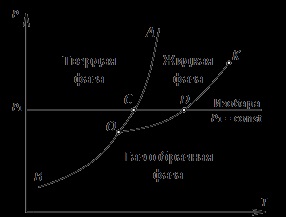
Fig. 4.1rT - substanță diagrama
Fig. 4.1 prezintă o diagramă caracteristică substanță pT cu depozitate pe acestea tranziții de fază curbe. În partea stângă a liniei AOB este o regiune a stării solide a materiei. Chiar de la linia RGB este o regiune de stat în formă de gaz a materiei, și între liniile OA și OC # 8210; regiune lichid. Din diagrama pT că curba linie OB reprezintă o substanță sublimare, linia OA - topirea curba (solidificare) și linia OK - curba de fierbere (condensare). Fierberea curba numită în mod normal, o curbă (sau linie) de saturație. Punctul O reprezintă punctul triplu la care o substanță în trei state coexistă. Curba OB sublimare continuă până la temperaturi scăzute. Curba de topire OA merge în direcția de presiuni mai mari. linia de saturație OK se termină la punctul K, numit punctul critic. Deoarece proprietățile diferitelor substanțe diferă unul de altul, iar pT-chart vor fi diferite pentru diferite substanțe.
La atingerea parametrilor critici (temperatură și presiune) substanța devine stare supercritică. Deasupra parametrii critici ai statului în două faze nu este realizabil. In starea supercritica, există numeroase molecule libere și clustere slab legate de molecule. Distanța dintre particule (molecule și clustere) sunt semnificativ mai mari decât într-un lichid clasic, dar mult mai puțin decât în gazele convenționale. In interiorul moleculele de cluster sunt aranjate aleatoriu. Energia interacțiunii moleculelor în grupuri mici. În același timp, viteza cu care moleculele individuale vin în grupuri și lăsându-le foarte mare. Prin urmare, viscozitatea extrem de scăzută și, în același timp, difuzivitatea ridicată a fluidului supercritic. Densitatea unui apropiat mediu fluid supercritic la densitatea, care asigură o putere ridicată de solvent. Combinația acestor proprietăți este baza utilizării practice a substanțelor unui stat supercritic.
Fig. 4.1 arată că linia de sublimare și linia de saturație sunt pozitive-negativ-prelate. Aceasta înseamnă că, odată cu creșterea presiunii temperaturii de tranziție de fază (fierbere și sublimare) crește. Această regularitate spraved-Liva pentru toate substanțele pure cunoscute. Linia de topire pentru diferiți compuși pot avea pantă atât pozitive cât și negative.
Din pT-diagrama (fig. 4.1) arată, de asemenea, modul în care starea materiei în procesul de încălzire la o presiune constantă. Mutarea de-a lungul unui p1 izobară = const regiunii corespunzătoare stării solide a materiei, linia de topire se intersectează în punctul C - substanța devine lichid. După încălzirea suplimentară intersectează linia de saturație OK la punctul D - materia este transformată în abur. avansarea în continuare a izobară p1 = const spre temperaturi mai ridicate corespunzătoare încălzirea substanței în faza gazoasă.
Căldura specifică a vaporizării indică cantitatea de căldură necesară pentru conversia 1 kg de lichid în vapori la temperatura de fierbere.
Căldura specifică a vaporizării este determinată de formula:
unde Q - cantitatea de căldură J; m - greutate, kg.
a găsit Empiric valori ale căldurii specifice de vaporizare a diferitelor substanțe și sunt compuse din tabel. Căldura specifică de vaporizare a apei este egală cu 2.257 MJ / kg. Acest lucru înseamnă că este necesară în fiecare kilogram de apă să-și petreacă cantitatea de energie egală cu 2257 MJ să-l transforme în abur. Dar trebuie să posede deja temperatura de fierbere a apei. În cazul în care apa a fost inițial o temperatură mai scăzută, este necesar să se calculeze cantitatea de căldură necesară pentru încălzirea apei la fierbere.
Există două tipuri de vaporizarea: fierbere și evaporare. proces rapid la fierbere continuă pe parcursul întregului volum la o temperatură strict definit (fierbere). Evaporarea are loc numai de la suprafața liberă a lichidului, la orice temperatură mai mare decât temperatura de topire.
entalpie abur saturat uscat i „este dată de:
în cazul în care i „- entalpia fluidului.
Energia internă a aburului saturat uscat:
u "= i" - p # 965; „(4.3).
Pentru a determina presiunea uscată de abur saturat sau temperatura de cunoștințele necesare. abur umed sau presiune determinată p și temperatura ti x gradul de uscare.
abur umed ix Entalpia determinată de ecuația:
Energia internă a ux abur umed este:
unde # 965; x - volumul specific al aburului umed, care este definit ca volumul amestecului format din abur uscat # 965; „și apă # 965; " :
Fiecare presiune corespunde unui anumit punct de fierbere al lichidului, care simultan cuplu Ts temperatura de saturație. cu care lichidul este în echilibru.
Relația dintre temperatura și presiunea de saturație este exprimată prin ecuația Clausius-Clapeyron:
ca # 965; „> # 965; " tranziție de fază „lichid-vapori“, după cum rezultă din ecuația, raportul - este întotdeauna mai mare decât zero, adică, odată cu creșterea temperaturii crește presiunea de saturație.
ecuația Clausius-Clapeyron stabilește relația dintre derivatul de presiune cu privire la temperatura, calorifică (r) și termodinamică (TH. # 965;“. # 965; „) proprietățile substanței în diferite stări agregate.
Problema 1. Câtă energie (căldură) este necesar pentru conversia în abur 2 kg de apă la temperatura t?
1. Definirea proceselor: fierbere, vaporizarea, evaporare.
2. Procesul de sublimare și topire.
3. Punctul triplu și punctul critic. stare supercritica.
4. Determinarea căldurii de vaporizare. Clapeyron
Montajul experimental pentru determinarea presiunii de saturație a apei în funcție de temperatură într-o regiune cu două faze în procesul de răcire izocoră prezentat în Fig. 4.2. Folosind această relație și Clapeyron - Clausius termic calculat de vaporizarea r.
Vasul de presiune 1. spiralat încălzitor electric 2. intensiv răcit de un ventilator 4. În afara vasului izolat carcasa 6. Pentru închidere automată pini încălzitorului prevăzut manometru 7. Presiunea în vas este măsurată printr-un manometru 8. exemplari Temperaturile de diferență și de saturație măsurate ambiental diferențială termocuplu 9. care este conectat cu un galvanometru 10. În aparat sunt prevăzute un ventilator încălzitor electric întrerupătoare 3 și 5.
Într-o presiune închis vas 1 este turnat apă, în care volumul specific # 965; x sistem bifazic de „lichid - vapori de“ (saturație abur umed) este egală cu valoarea critică:
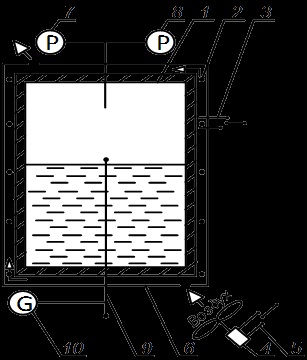
Fig. 4.2. Configurația experimentală
unde V - volumul rezervorului umplut cu un sistem de „lichid - vapori de“ m 3;
M - masa de „lichid - vapori“ sistem kg;
# 965; cr - volum specific în punctul critic al sistemului, m 3 / kg.
Ca rezultat, răcire izocoră (# 965; x = const) în orice moment sistemul va fi în stare de două faze, începând cu punctul critic.
Procedura pentru efectuarea de experimente
Înainte de începerea experimentului trebuie să permită sisteme de încălzire electrică. Când ajunge la o presiune de 220 kgf / cm2 (37 bari) pentru a dezactiva și activa ventilator electric. În plus, la răcire izocoră - sistem „lichid de vapori“ fiecare 4 diviziune scrisă în tabel. 4.4 Indicații ecartament exemplar și galvanometru.
La sfârșitul experimentelor (Rizb = 5 bari) pentru a dezactiva ventilatorul pentru măsurarea temperaturii ambiante Tamb și B. presiunea atmosferică Rezultatele măsurătorilor înregistrate în tabelul de date experimentale (tabelul 4.4.).