legături chimice 1. covalente formate prin doi electroni cu spin opus aparținând doi atomi. De exemplu, abordarea de doi atomi de hidrogen de o suprapunere parțială a orbitali de electroni, și formează o pereche comună de electroni
Legătura covalentă poate fi formată pe un mecanism donor-acceptor. Mecanismul de formare a legăturii covalente datorită pereche de electroni unui atom (donor) și un alt atom (acceptor), care prevede această pereche de liberă orbital numit donor-acceptor.
Să considerăm ca exemplu al mecanismului de formare a ionului de amoniu NH4 +. Molecula este divizat NH3 trei perechi de electroni formează trei comunicare N H, a patra pereche de electroni nepuse exterioare este, se poate da o legătură cu ionul de hidrogen, rezultatul este un ion de amoniu NH4 +:
Astfel, NH4 + ionul are patru legături covalente, toate cele patru legături N-H echivalent, adică densitatea de electroni este distribuită uniform între ele.
2. Formarea unei legături chimice covalente are loc suprapunerea funcțiilor de undă ale electronilor (Orbitali de electroni), iar legătura va fi cu atât mai puternic, cu atât mai mult această suprapunere.
3. Legătura chimică covalentă este în direcția în care posibilitatea de suprapunere a funcțiilor de undă ale electronilor ce formează comunicarea va fi cea mai mare.
4. valența atomului din normal (non-excitat) starea este determinată de:
- numărul de electroni nepereche care participă la formarea de perechi de electroni comune cu electronii altor atomi;
- Prezența abilității donatorului (în detrimentul unei perechi de electroni unshared).
In starea excitată este determinată de valența atomului:
- numărul de electroni nepereche;
- numărul de orbitali vacante capabile să accepte un donor de electroni pereche.
Astfel, valenta numere întregi mici exprimate și nu are nici un semn. Măsura este numărul de legături chimice de valență. că atomul este conectat la celălalt.
Pentru valență electronii sunt în primul rând un nivel extern, dar pentru sub-grupuri de elemente și includ electroni și penultimele nivele (predvneshnih).
Luați în considerare configurația electronică a atomului de bor:
unde B * - atom de bor într-o stare excitată.
atom de bor în starea fundamentală este monovalent. atom de bor în stare excitată are trei electroni nepereche și poate forma un compus, unde va trohvalenten. Energia consumată în tranziția unui atom într-o stare excitată în cadrul aceluiași nivel de energie, de obicei, mai mult decât compensată de energia degajată în formarea de legături suplimentare.
Datorită prezenței borului liber atom orbitali Forest - una dintre cele mai puternice Acceptoare perechi de electroni neîmpărtășite. De exemplu:
Rezultatul este un ion complex [BF4] -. având patru covalente s -bond.
Reprezintă diagrama de distribuție electronică a unui atom de azot:
Deoarece azotul are trei electroni nepereche, valență este de trei. Tranziția atomului de azot în stare excitată nu este posibilă, deoarece al doilea strat nu conține d-orbitali energie. Atomul de azot poate furniza o pereche de electroni unshared de atom electroni exterior având liberă orbitală (acceptor). De exemplu, în ionului de amoniu azotul este tetravalent (vezi alin. 1).
Schemele se suprapun de orbitali atomice în formarea de legături în moleculele de H2O, NH3. CH4
O moleculă de apă constă dintr-un atom de oxigen si doi atomi de hidrogen. Două electroni p neasociat atomii de oxigen ocupă două orbital, care sunt dispuse la 90 ° unul de altul. In formarea de molecule de apă în fiecare p orbital electroni se suprapun orbital s - (. Figura 7.1) de electroni al atomului de hidrogen.
Unghiul dintre legăturile trebuie să fie aproape de unghiul dintre nori p electroni, adică la 90. Aceasta a constatat experimental că unghiul dintre legăturile dintr-o moleculă de apă este egală cu 104,5. Acest lucru se datorează faptului că electronii sunt mai puternic atrași de atomul de oxigen, deoarece legătura O-H este o legătură covalentă polară. Astfel, există repulsie sarcinilor pozitive care rezultă din atomi de hidrogen, ceea ce conduce la o creștere a unghiului dintre legăturile.
In formarea de molecule de amoniac implică trei electroni p neasociat atomului de azot, orbitalii care sunt situate în trei direcții reciproc perpendiculare și trei s-electroni ai atomilor de hidrogen (Fig. 7.2).
Trei legături N-H din molecula de amoniac trebuie să fie poziționate perpendicular una față de alta, aproape de 90 °. Aceasta a constatat experimental că unghiul dintre legăturile din molecula de amoniac este de aproximativ 107,3. acest lucru se datorează același motiv ca și în cazul moleculei de apă. În plus, nu considerăm piesa 2S-electroni în formarea legăturilor chimice.
In formarea moleculei de metan atom de carbon devine excitat, adică are trei electroni p nepereche și s-electron.
Rationamentul în același mod ca și în cazurile precedente, se poate presupune că atomul de carbon va forma trei comunicări direcționate la un unghi de 90 ° unul de altul și de comunicare vizează în mod arbitrar, deoarece este format din s-electron și s-electron are simetrie sferică.
Deoarece p-orbitalii ale miezului mai alungite, s-orbital suprapunerea cu ei mai puternic orbitali alți atomi și, prin urmare, legăturile formate de p-electroni trebuie să fie mai robust. Dar este cunoscut din experiment că toate conexiunile din molecula de metan, iar echivalentul sunt direcționate către vârfurile unui tetraedru (unghiul dintre legăturile este de aproximativ 109,5.
Acest fenomen se explică prin noțiunea de hibridizare a funcțiilor de undă introduse de Pauling si Slater. Hibridizarea orbitalii de valență - această aliniere a formei și energia lor. Noțiunea de hibridizare este utilizată în cazul în care formarea de legături în molecula implicate electronii aparținând diferitelor tipuri de orbitali. Asymmetric hibrid orbital și puternic tras într-o parte a miezului.
Luați în considerare structura electronică a moleculei de metan, dar din punct de vedere al metodei de hibridizare. Patru electroni nepereche de atomi de carbon interacționează unele cu altele în timpul formării unei legături chimice cu alți electroni atom, dând patru noi nor echivalent hibrid. Această hibridizare se numește hibridizare sp3. Patru complet identice orbitali -Hybrid sp3 atom de carbon sunt înclinate aproximativ 109,5 unul de altul și sunt direcționate către nodurile tetraedru, al cărui centru este atomul de carbon (Fig. 7.3).
Acest fapt ridică întrebarea - este posibil să se poziționeze orbitalii de hibridizare pentru a explica formarea de legături chimice între atomii în moleculele de H2O și NH3. Orientarea obligațiuni în aceste molecule pot fi explicate folosind conceptul de hibridizare. Această abordare este chiar mai precis decât subliniat anterior. Acest lucru se datorează faptului că hibridul orbital este puternic întinsă într-o direcție de orbitalii de bază și hibride se suprapun cu alte orbitalii electronice ale atomilor este mai puternic decât suprapunerea orbitali de electroni S și p, ceea ce conduce la formarea unei legături puternice, și, prin urmare, și molecule mai stabile.
Înainte de a trece la structura moleculară a H2O și NH3 folosind modelul de hibridizare formează algoritmul pentru determinarea geometriei moleculei prin această metodă:
- necesare pentru a determina prezența sau perechi de electroni neîmpărtășite de electroni nepereche în atomii central (în poziția în sistemul periodic);
- ar trebui să găsească un număr de orbitali hibrizi este egală cu suma dintre s și -bonds ale perechilor de electroni nepuse ale atomului central;
- trebuie să setați tipul de hibridizare de orbitali:
Alte tipuri de hibridizare a funcțiilor de undă de electroni, de exemplu, hibridizare implicând d-orbitali.
formarea legăturilor chimice în moleculele de H2O și NH3 poate fi explicat din poziția sp3 hibridizării orbitali atomici de oxigen și azot (Fig. 7.4).
In timp ce atomul de carbon patru orbitali hibride sunt ocupate de electroni perechi de legare, atomul de azot este unul dintre cele patru orbitalii hibrizi ocupat pereche unshared de electroni (unghi de 107,3) și atomul de oxigen (figura 7.3.) - două orbital (unghi 104,5 o) (Fig. 7.4). Prin urmare, o acțiune de protecție contra perechilor de electroni nepuse afectează unghiurile legăturilor - în tranziția de la moleculele de metan la moleculele de apă și unghiul de valență amoniac scade.
-Comunicarea - legătura chimică formată ca urmare a suprapunerii orbitalilor electronilor de-a lungul liniei care leagă nucleele atomilor.
-Comunicarea - legătura chimică formată ca urmare a suprapunerii orbitali de electroni pe fiecare parte a liniei care unește nucleele atomilor.
valență metodă scheme de acoperire. delocalizat-bond
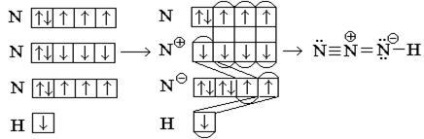
Luați în considerare schemele de valență metoda de suprapunere Exemplul azidovodoroda HN3. HN3 în molecula de atomi de azot legați unul de altul și conectate unul cu hidrogen.
Atomul central de azot poate fi trivalent datorită electronilor nepereche, dar în ambele cazuri raman in molecula doi electroni nepereche, făcând circuitul improbabil.
Transferăm cel al atomului central de s-electroni pe atomul de azot „superior“:
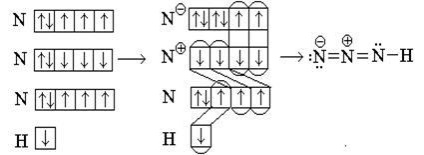
Diagrama echiprobabile obținută dacă mutați unul dintre s-electronii un alt atom al atomului central de azot: