
Acasă | Despre noi | feedback-ul
Sun se bazează pe următoarele ipoteze-cheie:
a) legătura chimică dintre cei doi atomi apare ca urmare a suprapunerii AO pentru a forma perechi de electroni (generalizate doi electroni);
b) atomii care formează o legătură, este schimbată între electronii care formează perechi de legare. schimbul de energie de electroni între atomii (atomi de energie atracție) contribuie la energia de legare. Contribuția suplimentară la energia de legare a forțelor de interacțiune Coulomb da particulelor;
c) legarea chimică a implicat electroni cu spin opus;
Caracteristici g) lipirea chimică (energie, lungime, polaritate, etc.) este determinată de tipul de suprapunere AO.
Structura electronică a moleculei diferă foarte mult de structura electronică a atomilor constituente. De exemplu, orbitalii de electroni ai moleculei de hidrogen nu are simetrie sferică, spre deosebire de un atom de hidrogen AO, deoarece perechea de electroni în două centre aparține sistemului molecular. În același timp, perechea de electroni de legare este la un nivel de energie mai mic decât electronii nepereche atomilor de hidrogen.
Ca rezultat, formarea moleculelor din atomii în curs de transformare doar structura electronică a atomilor exterior coajă și predvneshnih. De aceea, în care rezultă atomii de molecule cu structura electronică originală nu există. In atomii in molecula sunt păstrate numai configurația electronică a cojilor de electroni interioare, care nu se suprapun cu formarea de legături.
Capacitatea de a atașa atom sau înlocui un anumit număr de alți atomi pentru a forma legături chimice numite valență. Conform metodei Sun, fiecare atom face formarea de perechi de electroni de ansamblu (legătura covalentă) ca un electron nepereche. O măsură cantitativă a mecanismului de schimb de valență al forțelor armate ale metodei este numărul în sol sau în stare excitată de electroni neîmperecheați atomului. Acestea includ electronii nepereche ale cochilii exterioare ale atomilor și elemente p S-și coji exterioare predvneshnih elemente d-.
La formarea atom de legare chimică poate muta într-o stare excitată ca urmare separarea perechii sau a perechilor de electroni și trecerea unuia (sau mai mulți electroni egal cu numărul de vapori separați) orbitală a învelișului liber al acestuia. De exemplu, configurația electronică a calciului în starea solului 2 este scrisă ca 4s. În conformitate cu o metodă de soare valență mecanism de schimb este nulă, adică pentru Ca (... 4s 2) valentnostV = 0. La atomul de calciu, în al patrulea shell (n = 4) sunt p orbitali vacante. Când excita atomii și electronii se produce abur 4S- un electron liber se mută la 4S- orbital. valență de calciu în stare excitată este egal cu doi, adică, Aburire la o valență crește cu două unități.
Structura spațială a moleculelor.
Așa cum sa arătat anterior, legătura chimică covalentă este direcțională, care se datorează determina orientarea JSC în spațiu.
Bond format prin suprapunerea AO linie care unește nucleele combină atomii se numește # 963; -bond. exemple de educație # 963; -bonds sunt s-orbital se suprapun, p-S și orbitali, a p-orbitali, d-orbitali, precum d- și s-orbitali, orbitali d- și p, etc. Unele dintre exemple # 963; -bonds enumerate mai jos.
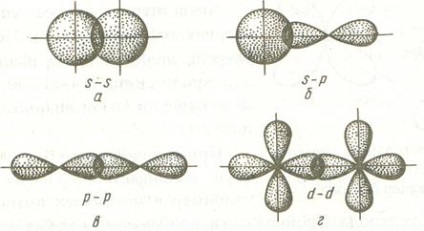
Puteți vedea că, în cazul # 963; zona -bonds de densitate maximă a electronilor este pe linia care leagă nucleele atomilor.
Bond format prin suprapunerea AO pe fiecare parte a liniei care unește nucleele atomilor (suprapunere laterală) se numește π-bond. π-legătură poate fi formată prin suprapunerea p-p, p-d, f-p, f-d și f-f-orbitali. Mai jos sunt exemple de formarea tt-obligațiuni.
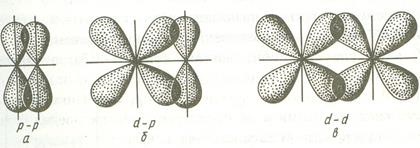
Deoarece formarea de gradul tt-obligațiuni de suprapunere a orbitali este mică în comparație cu # 963; -bond, energia acestor obligațiuni este semnificativ mai mic.
La aplicarea π pe conexiune # 963; -bond legătură dublă formată, de exemplu, moleculele de oxigen, etilena, dioxid de carbon:
La aplicarea celor două tt-obligațiuni pe # 963; -bond apare o triplă legătură, de exemplu, în moleculele de azot, acid acetilenă, cianhidric:
Cu cât multiplicitate de comunicare, cu atât mai mare de energie și inferior lungimea legăturii.
Unele forme ale compușilor nu pot fi explicate în termenii formării lor atomilor excitați sau neexcitat. Astfel, toate link-urile din molecula de metan C-H sunt egale, ceea ce contrazice setul de orbitali din atomii de carbon formează excitate și neexcitat. Sprijinul consistent al acestei și a altor fapte găsite în cadrul conceptului de hibridizare SA.
Hibridizarea - un amestec de diferite forme și energie orbitali de atomi, având ca rezultat formarea de același număr de orbitali de energie și formă hibride identice. Echivalenta orbitali hibride responsabile nu numai pentru formarea de legături echivalente de energie, dar, de asemenea, legătură similară unghiurilor dintre legăturile formate de acești orbitali. Trebuie subliniat faptul că hibridul format AO un atom având o diferite orbitali, în care hibridizarea orbital obiect sunt cu energii similare.
În cazul metanului, hibridizarea este rezultatul amestecării celor trei p-S și orbitalii audio în stare excitată de atomi de carbon, așa-numitul sp3 hibridizare.
Formarea orbitali hibride provoacă în mod avantajos energie prin acești compuși chimici orbitali. Acest lucru se datorează doi factori.
În primul rând, orbitalii hibride sunt asimetrice, ceea ce determină un grad mai mare de suprapunere în formarea legăturilor chimice și puterea lor mare.
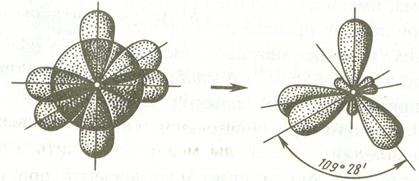
În al doilea rând, legătura dintre unghiurile orbitalii hibride mai mari de non-fuziune, rezultând într-un grad mai redus de repulsie între legăturile electronilor formate de aceste orbitali și face sistemul molecular mai stabil.
Când sp 3 -hybridization axei longitudinale a orbitali hibride de simetrie sunt situate una față de cealaltă, la un unghi 109º28 „- către colțurile respective ale unui tetraedru, centrul căruia este nucleul unui atom.
Dacă Hibridizarea este un obiect s și două p orbitali, un astfel de tip se numește hibridizare sp 2 - hibridizare și unghiurile dintre axele longitudinale ale acestor orbitali sunt egale și 120C corespund repulsia minimă dintre electronii de valență.
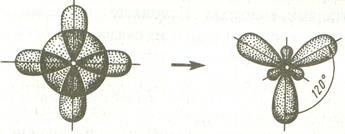
Când s- audio mixat și p-orbitali o deține SP-hibridizare. În acest caz, unghiul dintre valență orbitali hibrid 180 # 730; S.
Structura spațială a moleculei este determinată de numărul de atomi în moleculă, hibridizarea orbitali și numărul de electroni nepereche pe ele responsabile de formarea de conexiuni.
Molecula formată de doi atomi este liniară. În cazul în care învelișul exterior al atomului are două p electron nepereche, apoi suprapunerea lor orbitali AO alți atomi, molecule formate unghiulare. Astfel de atomi includ atomii de grupă elemente p-VI (O, S, Se, Te), configurația electronică a cochilii exterioare din care sunt prezentate mai jos.