Cele mai multe enzime pentru a efectua funcții catalitice coenzime necesare. enzime excepție sostavlyayutgidroliticheskie (protează, ribonuclează, lipazele) în compoziția nu au centrul activ al coenzime.
Coenzime sunt încorporate în situsul activ al enzimei și sunt implicate în mod direct în procesul catalitic. Dacă legătură covalentă - o coenzimă numita grupare prostetică (lipoate, biotina, FAD, FMN). Coenzime sunt de multe ori vitamine sau derivați ai acestora.
Apoenzimei determină transformări substrat de specificitate. Același Coenzima construit în diferite apofermentami pot participa la diferite transformări ale substratului. De exemplu, piridoxal fosfat (forma coenzima de vitamina B6) este implicată în reacțiile de transaminare și decarboxilare - totul depinde de apoenzimei cu care este asociat. Coenzime sunt:
pietre (grupare prostetică). O parte din citocromul, NO-sintaza, catalază, peroxidaza, guanilat ciclaza, citocromilor.
Ca multe alte proteine, enzime pot fi monomeri. și anume Acesta constă dintr-o subunitate ipolimerami. format din mai multe subunități.
Unele enzime, cum ar fi complexul multienzimatic piruvatdehidrogenazei, glicolizei legarea și ciclul acidului tricarboxilic, necesită cinci coenzime și organice ion un metal: pirofosfatul tiamină (THP) covalent svyazannyylipoamid și flavin adenin dinucleotid (FAD) co-substrat dinucleotid adenin nicotinamida (NAD), coenzima A (CoA) și ioni de magneziu (Mg2 +).
Centrele active și allosteric enzimă.
Ca parte a enzimei este zona izolata pentru a efectua diverse funcții:
1. activ centru - o combinație de resturi de aminoacizi (de obicei, 12-16), care asigură o legare directă a moleculei de substrat și de a efectua catalizei. Radicalii de aminoacizi din centrul activ poate fi prezentă în orice combinație, cu următorul aminoacid poate fi localizată în mod considerabil la distanță unul de celălalt într-o catenă liniară.
In enzime, având în componența sa mai mulți monomeri pot fi de mai multe centre active pe numărul de subunități. De asemenea, două sau mai multe subunități pot forma un singur centru activ.
In enzima complex situs activ poziționat în mod necesar grupe funcționale ale cofactor.
La rândul său, în site-ul activ sunt două motive:
Anchor (linking pin) - responsabil pentru legarea și orientarea substratului în centrul activ,
catalizator - este direct responsabil pentru punerea în aplicare a reacției.
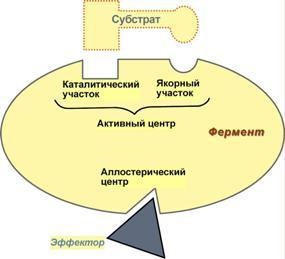
Schema structurii de enzimă
2. Centru alosterice (allos - oponent) - centrul reglarea activității enzimei, care este separat spațial de situsul activ și nu are la toate enzimele. Legarea la centrul alosteric al unei molecule (numit un activator sau inhibitor, și controlerul modulator efector) modifică configurația spațială a proteinei enzimei (situsul activ) și, ca urmare, viteza reacției enzimatice. Ca un astfel de regulator poate fi un produs al sau una dintre următoarele reacții substrat de reacție sau o altă substanță.
enzimele alosterice sunt în cele mai multe cazuri în structura proteinei cuaternară, centrele active de reglementare și pot exista în diferite subunități.