Definiția și clorurile cu formula
Acidul clorhidric este un acid monobazic, care suferă o disociere în soluție apoasă, conform următoarei ecuații:
HCI ↔ H + + Cl -.
formând astfel o sare - clorură (NaCl - clorură de sodiu, CaCl2 - clorură de calciu, AlCl3 -chlorides aluminiu, etc.).
În funcție de tipul de legături chimice între atomii în moleculă, distinge cloruri ionice, care sunt solide cristaline, cu puncte de topire ridicate; cloruri covalente care reprezintă ambele substanțe gazoase și solide sau lichide cu punct de topire scăzute. O parte considerabilă a clorurii sunt ușor solubile în apă.
Clorură de formule chimice
Formulele chimice cloruri considera exemplul NaCl - clorură de sodiu, CaCl2 - clorură de calciu și AlCl3 -chlorides aluminiu. Formula chimică prezintă compoziția calitativă și cantitativă a moleculei (numărul și tipul de atomi incluși în compusul specific) Conform formulei chimice poate fi calculată cu greutate moleculară de cloruri (Ar (Na) = 23a.e.m. Ar (Cl) = 35,5 AU m. Ar (Ca) = 40 amu Ar (Al) = 27a.e.m.):
Dl (NaCl) = Ar (Na) + Ar (CI);
Dl (NaCl) = 35.5 + 23 = 58,5.
Dl (CaCl2) = Ar (Ca) + 2 x Ar (CI);
Dl (CaCl2) = 40 + 2 x = 40 + 35,5 71 = 111.
Dl (AlCl3) = Ar (Al) + 3 x Ar (CI);
Dl (AlCl3) = 27 + 3 x 27 + = 35,5 106,5 = 133,5.
Structurale (grafice) clorurile cu formula
Structura (grafică), formula este mai intuitiv. Formula structurală, de exemplu, fosfați din aceeași NaCl - clorură de sodiu, CaCl2 - clorură de calciu și AlCl3 -chlorides aluminiu.
Fig. 1. Formula structurală de clorură de sodiu.
Fig. 2. Formula structurală de clorură de calciu.
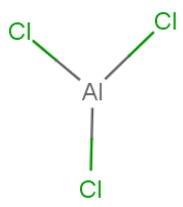
Fig. 3. Formula structurală a clorurii de aluminiu.
formula ionica
Clorurile sunt săruri medii capabile să disocieze în ioni în soluție apoasă:
NaCI ↔ Na + + Cl -;
CaCI2 ↔ Ca 2+ + 2CI -;
AICI3 ↔ Al 3+ + 3Cl -.
Exemple de rezolvare a problemelor
Când complet combustia cu oxigen care conține substanța organică cântărind 13,8 g au primit 26,4 g de dioxid de carbon și 16,2 g de apă. Găsiți formula moleculară a substanței, în cazul în care densitatea relativă a vaporilor de hidrogen este de 23.
reacția de ardere cartografiată compușilor organici având desemnat numărul de atomi de carbon, hidrogen și oxigen pentru «x», «y» și «z», respectiv:
Se determină masa elementelor care alcătuiesc substanța. Valorile maselor atomice relative luate din Tabelul Periodic D. Mendeleev, rotunjită la întregi: Ar (C) = 12 amu Ar (H) = 1 amu Ar (O) = 16 amu
Se calculează masa molară a dioxidului de carbon și apă. După cum se cunoaște, masa molară a moleculei este suma maselor relative atomice ale atomilor din molecula (M = Mr):
M (CO2) = Ar (C) + 2 x Ar (O) = 12+ 2 x = 12 + 16 32 = 44 g / mol;
M (H2O) = 2 x Ar (H) + Ar (O) = 2 x 16 = 1 + 2 + 16 = 18 g / mol.
m (C) = [26,4 / 44] x 12 = 7,2 g;
m (H) = 2 x 16.2 / 18 x 1 = 1,8 g
m (O) = m (Cx Hy Oz) - m (C) - m (H) = 13,8 - 7,2 - 1,8 = 4,8 g
Definim formula chimică a compusului:
x: y: z = m (C) / Ar (C). m (H) / Ar (H). m (O) / Ar (O);
x: y: z = 7,2 / 12 1,8 / 1: 4.8 / 16;
x: y: z = 0,6. 1.8. 0,3 = 2: 1 6.
Prin urmare, cel mai simplu compus cu formula C2 H6 O și masa molară 46 g / mol [M (C2 H6 O) = 2 x Ar (C) + 6 × Ar (H) + Ar (O) = 2 x 12 + 6 × 1 + 16 = + 6 + 24 16 = 46 / mol].
masa molara a materiei organice poate fi determinată prin densitatea la hidrogen:
Msubstance = 2 x 23 = 46 g / mol.
Pentru a găsi formula adevărată găsi raportul compus organic obținut masa molară:
Aceasta înseamnă un compus organic cu formula va lua forma C2 H6 O.