Acasă | Despre noi | feedback-ul
p-bond pot fi localizate și delocalizată. Localizate a numit-o legătură dublă, în care densitatea de electroni a p-legătura se referă numai la două nuclee atomi legați. caracteristică de obligațiuni delocalizat a sistemelor conjugate. Dacă molecula conține două legături duble (sau mai multe), separate printr-o legătură simplă sau atomul adiacent la dubla legătură, are o p-orbital, atunci p-orbitali de atomi adiacenți se pot suprapune formând un sistem comun p-electron. Acest sistem se numește conjugatul.
Există două tipuri de conjugare: p-p -conjugate și p p tensiune-conjugat. Un exemplu de simplu sistem -conjugate p-p este o moleculă de 1,3-butadiena. 1,3-butadienă molecula două p-obligațiuni sunt separate printr-un e-bond. Toți atomii de carbon sunt sp2-hibridizare, iar molecula are o structură plană. orbitali pz nehibridizate fiecare atom de carbon situat perpendicular pe acest plan ,. E. paralel unul cu altul. Acest lucru creează condițiile pentru suprapunerea reciprocă a acestora. Suprapunerea orbitali pz conduce la formarea unui singur nor p-electron. În acest caz, se spune că p-delocalizare a electronilor, adică. Sistem p conjugat E. P-format.
Dacă există o legătură dublă cu un atom cu un non-bonding p orbital, atunci acest tip de interfață se numește p-p. Pe p-orbitalii atomului este perechea de electroni singulară. In cele mai multe cazuri, în formarea p-p-împerecherea care implică heteroatomi - oxigen, azot, halogeni, sulf. electronii p orbital reacționează cu p-conexiune pentru a forma sistemul p-p-conjugat. Un exemplu este molecula eterul divinilic:
6 Polarizarea legăturilor chimice din molecule organice. Inductiv (I) și mezomerice (M) efecte electronice. Reprezentarea grafică a efectelor electronice
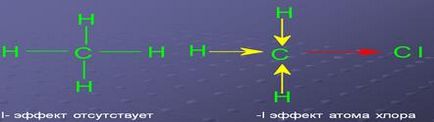
Polarității atomi de comunicare opredelyaetsyaelektrootritsatelnostyu. formând o legătură. Cu cât diferența în electronegativitatea atomilor legați, legătura polară. De exemplu, polaritatea de conectare.
Polarizabilitatea fenomen asociat cu o comunicarii creștere a reactivității comunicării datorită tulpinii sale mai ușoare.
Polarizabilitatea comunicării depinde de:
a) razele atomilor care formează această conexiune. Cu cât raza atomului, mai „vrac“, în învelișul de electroni al atomului, și cu atât mai ușor este deformat. De exemplu, comunicarea I-am mai ușor polarizabil decât o legătură CI-CI;
b) electronegativities atomilor ce formează legătura. Cea mai mare electronegativitatea atomului, mai compact shell l de electroni și cu atât mai greu să-l deformeze;
c) natura electronilor ce formează această conexiune.
legături duble și triple au format electroni tt-polarizat în mod considerabil mai ușor decât legături simple formate orbitali hibride.
comunicarea polarizabilitatea nu depinde de polaritatea
De exemplu, legătura dublă în molecula etilenei (CH2 = CH2) nepolar, dar este ușor polarizabil, și legătura C- CI semnificativ mai polar decât legătura C-I, dar mai puțin ușor polarizabil.
Astfel, polaritatea și polarizabilitatea de obligațiuni - un factor important care trebuie luat în considerare atunci când se analizează problema influenței reciproce a atomilor.