În cazul legăturii covalente localizată care leagă molecular orbital aparține doi atomi și este de doi centru doi electroni și clorhidric. În cazul în care una sau mai multe dintre orbitalii de lipire se întind peste trei sau așa ca mai mult numărul de nuclee, în acest caz, vorbim de obligațiuni delocalizate. obligațiuni delocalizat - este o legătură covalentă, orbitalii moleculare, fie că acoperă mai mult de doi atomi. Compușii tipici care conțin Tide sau sistem de interfață deschis-închis.
p-Orbitali mai mulți atomi se pot suprapune unele cu altele, de cotitură-Zuy total sistem π-electron. Acest tip special de influență reciprocă atomi de conjugare numit-mov. Conjugarea - o formare a unei singure molecule într-un nor de electroni delocalizat, ca rezultat al non-hibridizate suprapun tt-orbitali. Delocalizat MO pot fi împărțite în două sau mai multe L-obligațiuni, da tog acest tip de interfață se numește π, π-conjugare. Conjugarea poate participa π-bond și un atom învecinat cu p orbitală, atunci acest tip de interfață se numește p, π-conjugare.
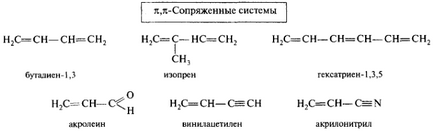

π, π-Mate. Cel mai simplu reprezentant al tt, sisteme π-conjugate cu catenă de carbon este 1,3-butadienă, în moleculă, care sunt 12 C într-o stare de sp 2 hibridizare. Atomii 12 C și 1 H într-un singur plan. toate # 963; -bond, de asemenea, se află în acest plan, formând # 963; -skeleton (# 963; -skelet). O distanță între 12 C legat printr-o legătură dublă (0,134 nm) și o lungime ceva mai mare C = C în etilenă (0,133 nm) și lungimea C-2-C-3 (0,147 nm) este în mod clar mai scurt decât legătura C-C (0.154 nm) în etan. Nehibridizate p-orbital perpendicular pe fiecare plan de 12 C. # 963; -skeleta și paralele între ele, ceea ce creează condiții pentru lor reciprocă ne de suprapunere și formează un nor de electroni pi.
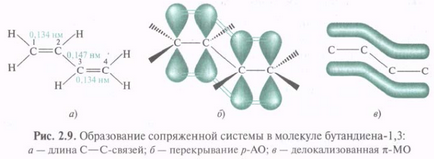
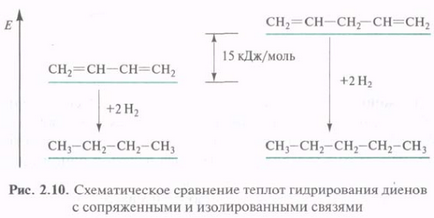
Suprapunere suplimentară p-AO care conduce la delocalizarea tt-electroni din sistemul conjugat, însoțită de eliberarea de energie, cu toate acestea compuși conjugat au un conținut mai redus de energie. Ele sunt stabile, ea, decât compuși cu legături multiple izolate. Diena conjugată este mai stabil decât neconjugată.
Câștigul în energia rezultată din conjugarea, conjugare numita energie (delocalizare energie). Pentru energie-butadienă-1,3-conjugare cu joasă (15 kJ / mol). circuit de interfață pot include numărul de durere-Choe a legăturilor multiple, caz în care energia de interfață poate deveni o valoare semnificativă. Cu cât sunt mai Cuplajul cu lanț, compus stabil.
p, π-Conjugarea se realizează în cazul în care așa-orbitali de duble (sau triple) tt-obligațiuni se suprapun cu p orbitală atomului adiacent și formează un singur sistem π-electron delocalizat. p, π-Conjugarea se realizează în moleculele care conțin fragmentul C = C # 7820;, în care X - heteroatom cu pereche liberă de electroni pe p-AO. De exemplu, vinildimetilamin și divinii eter:
Participarea 12 C p, π-conjugarea cu dubla legătură este posibilă numai dacă devine un radical cation sau anion. Când se întâmplă acest rehibridizarea un astfel de atom de sp 3 - sp 2 în -state. De exemplu, radicalii liberi sunt alil, alil cație HN și anioni. Radicalul în p-SA 12 C alil, împerecherea cu dubla legătură, 1 este un electron; cation alilic într-un conjugat-set intra vacant p orbital; în alil anion 12 C, transporta o sarcină conductive negativ, care furnizează un sistem pentru interfațare doi electroni. Delocalizarea densității electronilor în aceste particule duce la ele din, în stabilitate relativă.