Subiecte codificator examen. Modelul planetar al atomului.
Atomii fiecărui element chimic sunt strict individuale caracteristice spectrului linie numai acest element și nu schimbă de la un experiment la altul. Cum poate fi explicat acest lucru? Cum se obține o formulă care dă întregul set al spectrului de frecvențe atomice? Pentru a face acest lucru, aveți nevoie pentru a afla cum atomul.
Primul model al structurii atomice a inventat fizicianul englez Dzhozef Dzhon Tomson (premiul Nobel pentru descoperirea electronului). În cele din urmă sa dovedit a fi incorect, dar a jucat un rol important ca un stimulent studii experimentale ulterioare ale Rutherford. Fizicienii numesc modelul Thomson „prune budincă."
În conformitate cu Thompson atom reprezintă o dimensiune de ordinul cm balon. Prin această minge într-un mod distribuit sarcină pozitivă, iar electronii (Fig. 1) sunt în interiorul balonului, cum ar fi stafide ,.
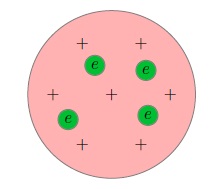
Fig. model de budinca de prune 1.
Sarcina totală a electronilor este exact egală cu sarcina pozitivă a balonului, astfel încât un atom este electric neutru ca întreg.
Radiațiile de la atomii explicat oscilațiilor de electroni despre pozițiile lor de echilibru (amintiți, fie în mișcare rapidă de încărcare radiază unde electromagnetice). Cu toate acestea, toate datele experimentale privind spectrele atomice nu se încadrează în modelul Thomson. De exemplu, unele elemente chimice au fost alese cu formula este bine descrisă prin spectrele lor, dar formula modelului Thomson nu urmează.
dacă modelul Thomson corect? De fapt, distribuit sarcini pozitive și negative în cadrul atomului? Pentru a răspunde la aceste întrebări, avem nevoie de un experiment pentru a obține în interiorul atomului. Elev Thomson, celebrul fizician engleză Ernest Rutherford a propus în acest scop, pentru a bombarda atomi cu energie înaltă? -particles si arata ca acestea vor fi respinse de sarcina pozitivă a atomului.
Ce este -particles? Fluxurilor acestor particule - așa-numitele „raze alfa“ - au fost găsite în dezintegrarea radioactivă a anumitor elemente (cum ar fi radiu). În urma unor studii aprofundate efectuate din nou Rutherford, sa constatat că fiecare -particle are o sarcină pozitivă egală în valoare absolută pentru dublul taxei de electroni și masă care depășește masa electronului este de aproximativ de ori. Ie-particula a fost complet ionizat (lipsit de electroni) atom de heliu.
Rutherford a vorbit despre modul în care particulele de ioni de heliu; Acum știm că acest lucru este un nucleu de heliu.
Dar, în acele zile ale nucleelor atomice nu au știut nimic - ei doar Rutherford a trebuit să ghicească, analizând rezultatele experimentelor sale celebre!
particule de energie este foarte mare - este suficient să spunem că viteza de plecarea lor din eșantion radioactiv este de aproximativ viteza luminii. Prin urmare, a fost interesant de a afla ce unghiuri va devia „bombe“ atât de puternic în imprastiere de atomi individuali - sau, mai degrabă, tarifele lor pozitive.
Un fascicul de particule îndreptate spre cea mai subțire folie de aur. Așa cum spune povestea, Rutherford a avut nici o îndoială că unghiurile de deviere trebuie să fie foarte mici: cu astfel de particule de energie enorme trebuie să treacă prin folia ca un cutit prin unt. Numai „pentru a șterge conștiința mea,“ doar în cazul, el a cerut elevilor pentru a vedea dacă există o dispersie de particule la unghiuri mari.
Îmi imaginez surprinderea tuturor, atunci când s-au găsit aceste particule! Da, așa cum s-ar putea aștepta, proporția covârșitoare a particulelor se abate nesemnificativ. Dar o foarte mică parte din ele (aproximativ o particulă de câteva mii), este deviat cu un unghi mai mare (fig. 2).
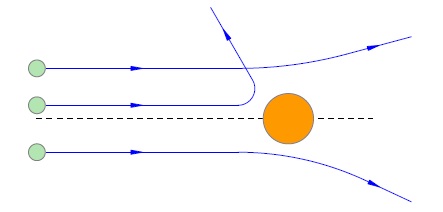
Fig. 2. Particulele de imprastiere pe atomii
Aceste anomalii par destul de incredibil. Potrivit lui Rutherford, cazul arăta ca un obuz a lovit o bucată de hârtie, iar lovitura sa întors.
O „hârtie“ în formă în comparație Rutherford a servit atom, aranjate conform modelului Thomson. Într-adevăr, să presupunem că sarcina pozitivă a atomului „uns“ de-a lungul atomului, care este, raza mingii cm. Această sarcină pozitivă creează un câmp electric și care inhibă deformare-particule. Aproape potențialul câmpului atomului:
Calculele arată, totuși, că un astfel de câmp este prea slab - acțiunea de frânare nu va fi suficient pentru a opri -particle și aruncă-l înapoi!
Astfel, prezența particulelor eliminate folie negată modelul Thomson. Ceea ce a fost propus în schimb?
Pentru a elimina -particle, sarcina pozitivă a atomului este de a crea un câmp electric mult mai puternică decât cea obținută în modelul Thomson. Și în scopul de a crea un astfel de câmp, sarcina pozitivă trebuie să fie concentrată într-o dimensiune mult mai mică a unui atom.
Dimensiunea acestei zone poate fi calculată. În cazul în care sarcina pozitivă ocupă o suprafață de mărimea. lângă taxa creează un câmp electric cu un potențial
Cunoașterea cinetic particulele de energie, se poate găsi valoarea potențialului de retardare. și apoi dimensiunea zonei încărcată pozitiv. Calculele efectuate de Rutherford a dat următoarele rezultate:
Această valoare este de cinci ordine de mărime (o sută de mii de ori!) Mai puțin decât dimensiunea unui atom. Deci, pentru a înlocui modelul Thomson a ajuns la modelul planetar al atomului (fig. 3).
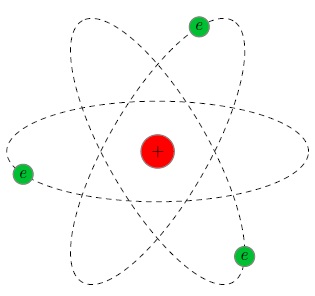
Fig. 3. Modelul planetar al atomului
In centrul atomului este un mic nucleu încărcat pozitiv. în jurul căreia precum planetele în jurul soarelui, electronii se deplasează. Între nucleul și electronii sunt Coulomb forțe de atracție, dar cad la electronii de bază nu poate fi în detrimentul mișcării lor - în același mod ca și planetele nu cad la soare, deși atras de ea.
modulo taxa nucleară egală cu sarcina totală a electronilor, astfel încât atomul este neutru electric ca un întreg. Cu toate acestea, electronii pot fi eliminați din orbita lor și lasă atom - atom apoi convertit într-un ion încărcat pozitiv.
Masa de electroni este o fracțiune foarte mică din masa totală a atomului. De exemplu, un atom de hidrogen, un singur electron, iar masa sa este mai puțin timp de greutate nucleu. Prin urmare, aproape întreaga masă a atomului este concentrată în nucleu - și asta în ciuda faptului că nucleul este o sută de mii de ori mai mică decât atomul însuși.
Imaginați-vă că atomul era de mărimea Ostankino Turnul TV (m) Pentru a obține o simt mai bine și raportul dintre scara nucleului atomic. Apoi, kernel-ul va fi de mărimea unui bob de mazăre mm, situată în mână. Și totuși, aproape întreaga masă a atomului este conținută în Mazare!
Asta-i un astfel de obiect uimitor sa dovedit a fi un atom. Dar modelul planetar al atomului, Rutherford explica rezultatele experimentelor pe împrăștierea particulelor, a fost doar primul pas spre intelegerea proceselor subatomice. Și anume, modelul planetar a rezultat într-o contradicție serioasă și de a depăși această contradicție de Niels Bohr a fost începutul fizica atomului. Citiți următoarea bucată de hârtie!
Sunați-ne: 8 (800) 775-06-82 (apel gratuit în România) +7 (495) 984-09-27 (apel gratuit de la Moscova)
Sau faceți clic pe „Aflați mai multe“ pentru a completa formularul de contact. Vă vom suna cu siguranță înapoi.