Electron dintr-un atom se mișcă. Din moment ce această mișcare nu este liniară, un electron are un moment unghiular
La începutul secolului trecut, când crearea modelului Bohr al atomului presupus că stările staționare ale unui atom sunt doar cele în care momentul cinetic este egală cu un multiplu întreg al h constanta lui Planck. împărțită la 2π. Acest lucru a permis Bohr pentru a calcula liniile de hidrogen observate în spectrul.
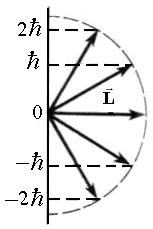
Momentul cinetic cauzate de mișcarea în spațiu sunt denumiți orbitala. Conform teoriei cuantice, magnitudinea momentului cinetic orbital este
unde l - numărul cuantic orbital care preia valorile 0, 1, 2. Astfel, momentul L. impuls de electroni, deoarece energia este cuantificată. și anume Este nevoie de valori discrete. De la teoria cuantică este o altă concluzie importantă: impulsul de proiecție a unui electron în orice direcție dată în spațiu z (de exemplu, direcția de linii magnetice de forță sau de câmp electric), este, de asemenea, cuantificați de regula:
Un electron se deplasează în jurul nucleului, reprezintă un curent electric circular elementar. Conform teoriei clasice a fenomenelor electromagnetice, închis curent este sursa de magnetism. Din experiență, rezultă că efectul magnetic al curentului închis (o buclă de curent), se determină dacă produsul cunoscut puterea curentului i în zona circuitului S. Acest produs se numește momentul magnetic. Noi o notăm cu μ. μ = Sunt. Gasim momentul magnetic legătură cu un moment unghiular L. Ca un exemplu, ia în considerare mișcarea unei particule de masă m și sarcină q de-a lungul circumferinței rază r cu vA frecvență.
Pentru microparticulele teoria cuantică conduce la aceeași conexiune și momentelor magnetice orbitale mecanice ale electronului. Acum q = e (e <0!) - заряд электрона, m - его масса).
Datele experimentale (divizarea fină a liniilor spectrale, rezultatele Stern-Gerlach - spune despre acest lucru mai târziu) a spus că electronul este capabil să 1s (orbital număr cuantic l = 0, și, prin urmare, L = 0) are un zero non-impuls unghiular S. nu sunt asociate cu mișcarea particulelor în ansamblu. Acest impuls unghiular numit de spin (rotire, englezii de rotire, rotire). Odată cu introducerea conceptului de „Spin“, sa presupus că electronul poate fi considerat ca un „titirez“, și spate - ca o caracteristică a rotației.
Spin numere cuantice ale electronilor s = 1/2 (aceeași valoare pentru proton, neutron, și un număr de particule). Numărul cuantic de proiecții. Ie numai două proiecții.
Momentul unghiular de spin este proporțională cu spin magnetic pS momentului
Distribuția energetică a nivelurilor de energie. Principiul Pauli
În cazul în care particulele au aceleași numere cuantice identice, funcția lor de undă este simetrică în raport cu rearanjarea particulelor. Rezultă că cele două fermioni identice, același sistem nu poate fi în aceeași stare, ca pentru fermioni, funcția de undă trebuie să fie antisimetrică. Fermionilor - particule cu splina jumătate de număr întreg.
principiul de excluziune: Într-o anumită stare poate fi nu mai mult de un fermion. Pentru un electron, ceea ce înseamnă că într-un stat cu numere cuantice date (n, l, m,) pot fi nu mai mult de un electron. Principiul de excludere al lui Pauli ajuta explica de ce electronii dintr-un atom nu merge dintr-o dată la starea de sol cu energie instantanee. Pe baza principiului lui Pauli se explică prin sistemul periodic.