1. Concepte chimice de bază. substanță
Exemple de soluții de probleme tipice
VI.Vyvod compus cu formula
Rețineți că raportul dintre valorile indicilor din formulă este egal cu raportul dintre atomii elementului substanță din compus și astfel raportul dintre elemente materiale. Deci, pentru substanța, formula este O 5. P2 poate fi scris:
Dacă formula binară sclav AX compus. putem scrie:
Deoarece în locul elementelor de masă m (A) m (B) pot fi înlocuite cu fracțiunile lor masă de w (A) și w (B), deoarece acestea sunt proporționale cu masele, dar în schimb masa molară M (A) și M (B) - valorile corespunzătoare ponderile relative atomice ale elementelor a r (a) și a r (V). Atunci obținem:
Sarcina 2 6. Oxid de fier oxigen necunoscut fracție de masă de 27,59%. Ieșire formula oxid.
1. Se calculează fracțiunea de masă a fierului din oxid de:
2. Din formula obținem:
Răspuns: Formula oxid - Fe 3 O4.
Sarcina 27. Mass fractie de potasiu legătura sa cu fosfor este de 79,05%. Compus ieșire formula.
Vom oferi un alt mod de a rezolva această problemă.
1. Se calculează fracțiunea de masă a fosforului:
2. Să presupunem că avem conexiune la 100 g CH HV. atunci
3. Se calculează cantitatea de potasiu substanță și fosfor. M (K) = 39 g / mol, M (P) = 31 g / mol:
4. calculează raportul dintre cantitățile de substanță de elemente:
Cu toate acestea, deoarece indicii trebuie să fie întregi, fiecare dintre numerele de produși și raportul dintre cea mai mică dintre ele:
Raspuns: Formula unui compus - K3 G.
28. Sarcina Fracțiunea masă de carbon, hidrogen și oxigen din compusul organic sunt, respectiv, 40, 53,33 și 6,67%. Set true substanță formulă dacă ei masa molară de 180 g / mol.
1. compute formulă simplă substanță. A r (n) = 1 și r (C) = 12, A r (O) = 16:
Prin urmare, cele mai simple substanțe cu formula - CH2 O. Cu toate acestea, această formulă nu este adevărat, deoarece M (CH2 O) = 30 g / mol în loc de 180 g / mol.
2. Pentru a stabili formula adevărată, cântărire faptul că acesta este un multiplu de cele mai simple, și anume, (CH2 O).
Sarcina 29. Fracțiunea de masă de carbon, hidrogen și oxigen în molecula de acid carboxilic sunt, respectiv 40.68, 5.08 și 54.24%. masa molara de acid în 2.565 de ori masa molară a primului membru al seriei omoloage de acizi monocarboxilici saturați. Formula de acid ieșire.
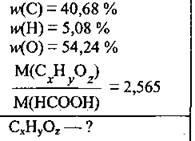
1. Primul membru al acizilor din seria omoloagă - metan HCOOH acidului (M (HCOOH) = 46 r / mol). masa molara a acidului necunoscut:
2. Să presupunem că avem 100 g Cx Hy Oz. atunci:
3. Conform formulei va calcula numărul de elemente de substanțe. A r (C) = 12, A r (n) = 1, A r (O) = 16:
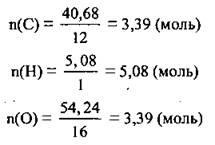
4. calcula valorile valorilor raportului de substanțe fiecare element:
Pentru fiecare dintre raportul întreg al numerelor extrase, împărțit cea mai mică dintre ele (3.39)
Cu toate acestea, n index (H) = 1,5 nu este un număr întreg, de aceea, pentru a obține valori întregi, fiecare număr în raport se înmulțește cu 2:
Prin urmare, cele mai simple substanțe cu formula - C2 H3 O 2.
5. Stabilirea unei formule adevărate. Acesta trebuie să fie un multiplu de cel mai simplu, adică (C 2 H 3 O 2) a. M (C 2 H 3 O 2) = 59 g / mol:
R: Adevaratele Substanțele cu formula - C4 H6 O 4. este acidul succinic.
Problema 30. Set formula true compus care cuprinde atomi de carbon, hidrogen și oxigen, în cazul în care raportul dintre masele lor este respectiv 1. 8. 16. Masa molară a compusului - 150 g / mol.
1. În conformitate cu starea problemei la fiecare 8 g de carbon în conturile combinate pentru 1 g și 16 g de hidrogen cu oxigen. M (H) = 1 g / mol, M (C) = 12 g / mol, M (O) = 16 g / mol. Noi găsim cele mai simple ingrediente formula:
2. Pentru toate întreg raportul multiplica 3:
Prin urmare, cele mai simple substanțe cu formula - C2 H3 O 3.
3. Stabilirea unei formule adevărate. Acesta trebuie să fie un multiplu de cele mai simple, și anume: (C 2 H 3 O 3) a. M (C 2 H 3 O 3) = 75 g / mol.
A: compus cu formula este adevărată - C4 H6 O 6. este acidul tartric.
31. Sarcina de căutare hidrocarbură formula adevărată, dacă raportul masic de carbon și hidrogen în ea este 1 6, iar densitatea relativă a compusului prin aer 1,931.
1. Conform condiției 6 g de carbon în conturile combinate pentru 1 g de hidrogen. Deducem formula simpla de ingrediente:
Prin urmare, cele mai simple substanțe cu formula - CH2.
2. utilizează datele despre densitatea relativă a substanței în aer și calculează masa molară a compusului. (. Pansament) M = 29 g / mol:
3. Găsiți adevărata substanță formula (CH2) a. M (CH2) = 14 g / mol, M (C x H y) = 56 (g / mol):
Răspuns: Adevărata formulă a hidrocarburilor - C4 H8.
Sarcina 32. Fracțiunea de masă a oxigenului în alcool monohidric saturat este de 26,67%. Se determină numărul total de atomi din molecula de alcool.
Numărul total de atomi -.
1. Scriem formula pentru determinarea fracțiunii de masă a elementului în substanța:
Formula de calcul a alcoolului greutate moleculară relativă:
2. substituent alchil cu greutate moleculară relativă:
3. Deoarece substituentul H2N C n formula alchil + 1.
Astfel, alcoolul cu formula - C3 H7 OH. Numărul total de atomi - 12.
A: Numărul total de atomi - 12.