I. Fermenty- catalizatori biologici ai naturii proteinelor, capabile să accelereze reacții chimice de multe ori apar vorganizme, dar ele nu fac parte din produsele finale de reacție.
Substanțele care acționează enzima numite substraturi.
Toate varietate de reacții biochimice care au loc în microorganisme, plante și animale este catalizată de enzimele adecvate. Rolul enzimelor în tehnologia alimentară. Baza producției de orice minciună produs alimentar, fie biochimice (enzimatice) sau procese fizico-chimice sau procesele sunt cuplate.
Spre deosebire de catalizatori anorganici, enzime au propriile lor caracteristici:
Rata Ø catalizei enzimatice cu mai multe ordine de mărime mai mare (de la 10 cu 3 de 10 acompaniat de 9) decât catalizatorul nonbiologică;
acțiunea Ø fiecărei enzime este foarte specific, adică, fiecare enzimă acționează numai pe un substrat sau un grup de substraturi aferente;
Enzimele Ø catalizează reacții chimice în condiții blânde, adică la presiunea ambiantă, temperatură ridicată (20-50 ° C) și la valori ale pH-ului mediului, în majoritatea cazurilor, aproape de neutru.
În ceea ce privește localizarea enzimelor în celula în care sunt împărțite în extracelular și intracelular.
enzime extracelulare sunt secretate de o celulă vie pentru mediul exterior, intracelular - sunt fie în organite celulare, fie în combinație cu structuri supramoleculare.
Un grup special de enzime constituie complecși polyenzyme, care includ un număr de enzime care catalizează reacțiile succesive de conversie orice substrat. Aceste complexe sunt localizate în structuri intramoleculare, astfel încât fiecare enzimă este situată în imediata vecinătate a enzimei cataliza o reacție în circuitul acestei secvențe de reacție. Datorită acestei enzime aranjament substrat de difuzie și produșii de reacție este redus la minimum.
II. Enzime - compuși bogate în proteine.
Ca și alte proteine, enzime au 4 nivele de structură, are toate proprietățile fizico-chimice ale proteinelor, și doar o singură trăsătură distinctivă - capacitatea de a accelera reacțiile chimice. Enzimele pot fi simple - o singură componentă și complex din două componente.
Enzimele monocomponent - construite din lanțuri polipeptidice, și numai aminoacizi se descompun prin hidroliză.
Enzimele din două componente - sunt compuse din porțiunea de proteină - părți apoformenta și non-proteice - cofactor. Ambele componente au în mod individual nicio activitate enzimatică. Numai uniți împreună (holoenzimatic) dobândesc proprietățile caracteristice ale biocatalizatori. Rolul cofactor poate efectua orice ion (Zn2 +. Mg 2+. Fe 2+. Cu 2+. Mai puțin K + și Na +) sau compus organic (vitamine, nucleotide). Cofactori natură organică sunt numite coenzime.
tip de conexiune între cofactor și apoenzimei pot fi diferite. În unele cazuri, acestea sunt separate și sunt conectate doar la momentul reacției; în alte cazuri, cofactor și apoenzimei sunt asociate în mod constant, legături puternice, uneori covalente.
Site-ul activ al enzimelor este o regiune locală a unei molecule a enzimei, care este implicată în actul catalizei. Centrul fermentahaktivny one-component este formată prin orientarea specifică a resturilor de aminoacizi ale lanțului polipeptidic. De obicei, este nevoie de formarea unui număr mic de aminoacizi participă în cadrul 12-16. Grupările funcționale ale acestor aminoacizi pot aparține legături lanțul polipeptidic, la distanță unul față de celălalt. convergența lor asociată cu formarea de structuri terțiare ale enzimelor.
Enzimele bicomponente centrul activ este un complex de cofactor și unele resturi de aminoacizi adiacente.
Centrul activ distinge pini (ancora) porțiune a cărei funcție - pentru a lega substratul, și un catalizator - în cazul în care conversia substratului în produșii de reacție după legarea sa la porțiunea de contact. In formarea acestor zone următoarele grupe funcționale care iau parte: grupări COOH sau dicarboxilici grupări amino terminale ale lanțului polipeptidic; grupa imidazol de histidină; OH-grup de serină; NH2 - grup de lizină și grupările terminale ale lanțului polipeptidic; gruparea fenolică a tirozinei și resturile hidrofobe de aminoacizi alifatici.
III. Orice viteză de reacție enzimatică este determinată printr-o barieră de energie. care este necesară pentru a depăși moleculele reactive. Potrivit Arrhenius, o reacție chimică în ceea ce privește energia procesului descris de ecuația
unde N - numărul de molecule active; N0 - numărul total de molecule de reactant; e - baza logaritmului natural; R - constanta de gaz; T - temperatura absolută; EAKT - energia de activare.
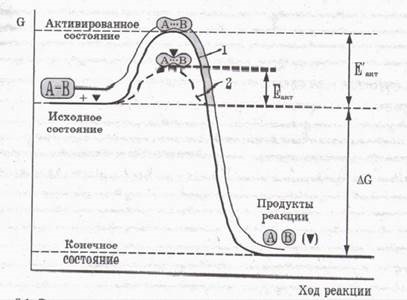
Cea mai importantă funcție a enzimei - reducerea catalizată a energiei de activare a pro-Ces-sa. Fig. 1 este un grafic al schimbării de energie (2) reacții non-enzimatice (1) și enzimatice. Enzima reduce înălțimea barierei-ti-agenție de energie (EAKT <Е¢акт ).
Fermi mecanism tativ-cataliza este încă neclar în multe privințe. Cu toate acestea, un rol major în crearea cineticii enzimatice jucate de M. Michaelis și M. Menten, în care a fost dezvoltat ideea complexului enzimă-substrat. Formarea acestui complex și conduce la o scădere a energiei de activare.
cataliză proces enzimatic poate fi împărțită în trei etape:
1. S sterică legarea la situsul activ substrat fer-ment E (formarea complexului enzimă-substrat ES).
2. Transformarea complexului primar în ES activat
Trecerea ES Complexul ≠.
3. Separarea produsului F final reacția enzimei.
Prima etapă de scurtă durată și independentă de concentrația de substrat și enzimă în mediu, prin viteza de difuzie a substratului la situsul activ al enzimei. La formarea unui complex de ES-predare se pot actualiza în diferite combinații, ca covalentă, lipire coordinativă, ionice și formează legături mai puțin stabile - atracția electrostatică a grupelor polare, van der Waals de coeziune între legăturile de hidrogen porțiuni molecule nepolare. Natura acestor obligațiuni se datorează caracteristicilor chimice și a substratului, și grupările funcționale în situsul activ al enzimei.
A doua etapă este, de fapt, acționează cataliza, adică act de rupere sau formarea de noi conexiuni în substrat; este cel mai lent și limitează viteza reacției chimice. In acest stadiu, și o reducere a energiei de activare a reacției enzimatice prin formarea complexului de tranziție activă ES ≠.
La nivel molecular, o înțelegere mai clară a mecanismului de acțiune al enzimelor dă teoria catalizei acido-bazic. Orice reacție care merge cu ruperea legăturilor covalente, implică două componente opuse ale naturii-ing electronic. Electronii sunt rupte din cauza necesității de a avea o componentă bună electro-philous timp și du-te la un nucleofil. Reactivi, Koto-secarei ar putea determina o astfel de reglaj electronic - este un acid și o bază. Cu toate acestea, într-una și aceeași soluție pentru a crea un concurent-Menno concentrații mari ale ambelor componente este imposibil, poskol-ku neutralizează reciproc. Proteina enzima molecula BLA Godard de fixare de pe situsul catalitic al grupurilor electrofile și nucleofile nici o reacție directă de neutralizare. Este, de fapt, definește actul de cataliză. Fiind la o anumită distanță unul de altul grupe electrofile și nucleofile ale situsul catalitic al enzimei nu numai că se leagă la substrat grupe de para-al, dar, de asemenea, are un efect puternic al polarizator substratului în grupuri. La aceasta se adaugă posibilitatea de a taxelor de fluctuații în complexul ES, care creează un grad ridicat de eficiență a polarizării. Acesta este motivul pentru scaderea energiei de activare în cataliză enzimatică.
În conformitate cu teoria covalente catalizei unele fer-mente interacționează cu substraturile lor, care formează complecși enzimă-substrat legate covalent instabile. Din aceste comp-Lex în reacțiile ulterioare, produsele de reacție sunt formate, decât atunci când-este mult mai rapid decât în cazul reacțiilor necatalizată.
Astfel, a treia etapă, culminând cu formarea produșilor de reacție este asigurată prin procese care rulează pe etapele de pre-cedente.