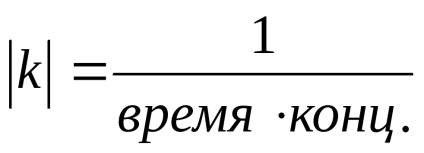Rata de reacție chimică este numărul de evenimente elementare ale reacțiilor chimice care au loc pe unitatea de timp pe unitatea de volum (pentru reacția omogenă) sau într-o unitate de suprafață (pentru reacții eterogene).
Viteza de reacție chimică se schimbă concentrațiile reactanților pe unitatea de timp. Distinge viteza medie
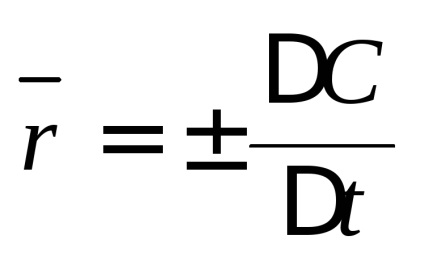
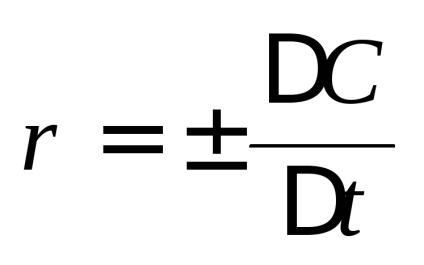
Una dintre provocările cu care se confruntă cinetica chimică, este de a determina compoziția amestecului de reacție (adică, concentrațiile reactanților) în orice moment, ceea ce este necesar să se cunoască dependența vitezei de reacție de concentrația. În general, cu cât concentrația reactanților, cu atât mai mare viteza unei reacții chimice. În cinetica chimică se bazează pe legea acțiunii de masă:
Rata de reacție chimică
Coeficientul k este constanta de proporționalitate a vitezei de reacție chimică. Constanta de viteză este numeric egală cu viteza de reacție la toate concentrațiile reactanților egale cu 1 mol / l.
Dependența vitezei de reacție asupra concentrației reactanților este determinată experimental și se numește prin ecuația cinetică a reacției chimice. Evident, pentru a înregistra ecuația cinetică, este necesar să se determine experimental magnitudinea constantele vitezei și exponenților la concentrații ale reactanților. Exponentul la fiecare concentrație a reactanților într-o ecuație cinetică, pentru reacția etochastny reacție chimică pentru această componentă. Suma exponenților în ecuația cinetică a reacției chimice (n1 + n2 +.) Reprezintă soboyobschy ordinea de reacție. Trebuie subliniat faptul că ordinea de reacție este determinată doar din datele experimentale și nu este legată de coeficienții stoichiometrice de reactanți în ecuația reacției. Ecuația reacției stoichiometric este ecuația de bilanț material și poate, în nici un mod de a determina natura acestui timp de reacție.
Basic (simplu) numit de reacție care are loc într-o singură etapă. Ele sunt clasificate de obicei prin moleculară - numărul de particule care, în conformitate cu mecanismul de reacție stabilit experimental implicat în actul elementar de interacțiune chimică.
Monomolecular - reacții în care există o conversie chimică a unei molecule (izomerizare, disociere, etc ...):
I2I • + I •
Bimolecular - reacție act elementar care se realizează atunci când o coliziune a două particule (identice sau diferite):
Trimolecular - reacție act elementar care se realizează atunci când o coliziune a trei particule:
Reacții cu moleculară mai mult de trei necunoscute.
Pentru reacțiile elementare efectuate la concentrații similare de materii prime, și ordinea de magnitudini ale reacției moleculare coincid. Cu toate acestea, nici o relație între conceptele de ordine moleculare și reacția nu există bine definită, deoarece ordinea reacției caracterizată prin ecuația cinetică pentru reacția și molecular - mecanismul de reacție.
Dacă C1 = C2 = ... = 1, k = r. și anume constanta vitezei este viteza reacției la această temperatură și la toate concentrațiile de reactanți individuali. Viteza de deplasare înainte și înapoi reacțiile sunt la echilibru, iar constantele raportul pryamoyk1 și obratnoyk 1 în care viteza corespunde constanta de echilibru
A treia caracteristică importantă este ordinea cinetică a reacției. Aceasta este o măsură sumară a gradului în ecuația experimentale, care determină dependența vitezei de concentrația reactantului. În general, procedura nu coincide cu moleculara, deoarece nu reflectă raportul stoechiometric în care are loc o interacțiune totală (aceasta determină reacția moleculară), iar mecanismul actual al procesului în condiții specifice. Prin urmare, în contrast cu moleculare, care este întotdeauna exprimat de un număr întreg și poate fi egal cu zero, procedura poate fi exprimată ca fracții sau egal cu zero. Procedura de mai sus a doua, practic, nu se produce deoarece coliziune simultană a trei sau mai multe particule este puțin probabilă.
Luați în considerare caracteristicile reacțiilor 1 și ordinul 2.
Reacțiile de ordinul 1. Dacă un sistem de volum constant, viteza de reacție este determinată de ecuația
După integrarea expresiei (7) în raport cu timpul între 0 și tp la concentrații otC0 Ðốc obține
sau dacă după x indica cantitatea de substanță a reacționat la momentut, toS0 sau -C = x
Am găsit o jumătate de viață, adică, timp în care materia primă este reacționat exact jumătate de reacție t1 / 2 al primului ordin.
(8) care:
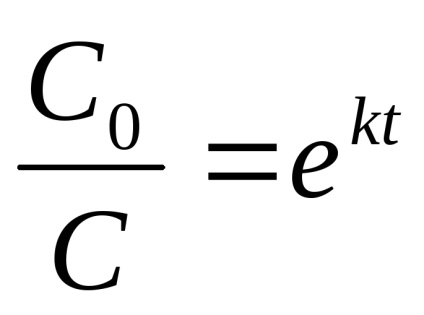
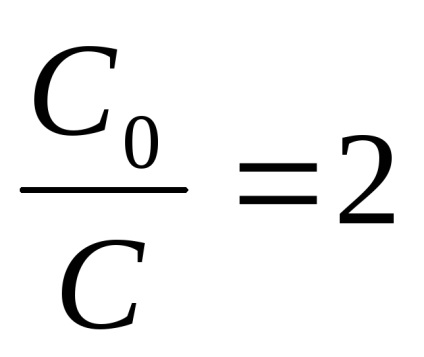
Din cele de mai sus rezultă că nu depinde de unitățile de alegere și concentrare determinate numai de unități de sincronizare pentru reacția de viteză de ordinul 1 valoare numerică constantă

Reacția lui ordinul 2. În cel mai simplu caz,
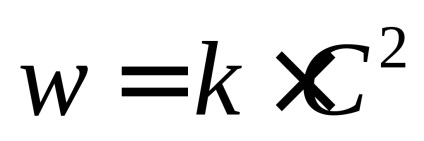
sau
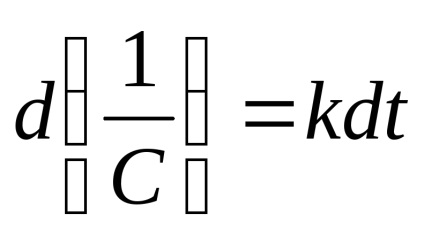
Timpul de înjumătățire corespunzător
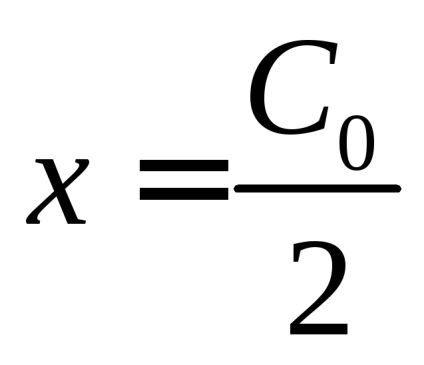
Din (14) rezultă că valoarea numerică a constantelor de viteză de reacție de ordinul doi, determinat prin alegerea unităților de concentrare