Ordinea reacției este suma exponenților concentrației de factori care determină variația vitezei de reacție.
Pentru ecuația cinetică în formă (8) este egală cu ordinea reacției:
Reacțiile complexe nu este întotdeauna posibil să se determine ordinea reacției, care ia în considerare influența tuturor reactivilor. În acest caz, ordinea de reacție utilizează conceptul de substanță, de exemplu, ordinea de reacție pentru substanța A.
Rezultă că constanta de viteză este întotdeauna numeric egală cu viteza de reacție pentru concentrațiile unitare, iar dimensiunea sa depinde de ordinea reacției.
Molecularity reacție chimică determinată de numărul de molecule (particule) care participă la evenimentul de reacție elementar.
Distinge una (A = B A = B + C, A = B + C + D), doi (2A = B, A + B = C) și trei molecule (+ 2B = C A; 3A = C) reacția .
Motivele pentru discrepanțe și ordinea reacțiilor moleculare.
N și oryadok moleculare coincid doar pentru reacțiile simple, cu o singură treaptă. Există două motive pentru discrepanțe și ordinea moleculară:
1. constanța concentrației unuia sau mai multor participanți la reacție (o reacție în atmosferă).
2. Natura în trepte a reacției (dacă este 2A reacție + B = C este în două etape, ordinea de al doilea, și molecularity egal cu trei).
În cazul în care etapele individuale de viteză sunt foarte diferite, atunci viteza de reacție, în general, și ordinea este determinată de viteza și ordinul cel mai lent pas.
Nu toate ecuațiile cinetice au forma ecuației (8) Că acestea pot include funcții mai complexe concentrații inițiale, produșii de reacție, catalizatori, inhibitori. Dacă reacția se realizează în două moduri, de exemplu prin catalitică și non-catalitice, ecuația cinetică trebuie să includă doi termeni care corespund acestor căi. Ecuația cinetică complet trebuie să conțină expresia constanta de echilibru, adică, aceasta ar trebui să includă termeni pozitivi și negativi, deci în cazul în care viteza de reacție este egală cu zero, obținem ecuația pentru constanta de echilibru. Cu toate acestea, multe dintre echilibru astfel deplasat spre formarea de produse care pot fi găsite doar o ecuație cinetică pentru reacția înainte.
Cinetica reacțiilor în condiții statice
Reacțiile sunt de obicei caracterizate printr-o ecuație cinetică care permite calcularea constantei vitezei în orice moment, de la început, și un timp de înjumătățire t1 / 2. care determină când reducerea concentrației inițiale a reactanților în jumătate.
Jumătății Perioada se numește interval de timp în care concentrația inițială a reactantului este redus la jumătate.
reacție de ordinul zero
Există o viteză de reacție care nu variază în funcție de concentrația unuia sau mai multor reactanți, deoarece nu este determinată de concentrare, și alți câțiva factori de limitare, cum ar fi absorbția luminii într-o reacție fotochimică sau cantitatea de catalizator în reacțiile catalitice. De asemenea, se referă la reacții similare în atmosferă de ardere. atunci
Reacția catalitică poate fi de ordinul întâi în ceea ce privește catalizatorul și ordinul zero în raport cu reactanții.
Constanta de integrare se găsește de la condițiile inițiale la t = 0, c = c0. Apoi = const c0, iar ecuația devine:
Ea exprimă o dependență liniară de concentrație și de timp pentru a determina modul în care rata constanta k0 = -tga.
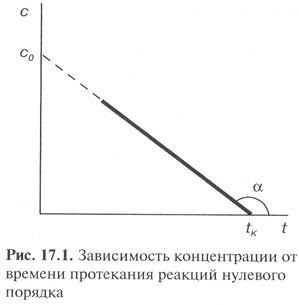
De la (11), ecuația cinetică este obținută pentru o reacție de ordinul zero
Dimensiunea ratei constante mol / l · s.
Conform ecuației (13) se poate obține expresia pentru o jumătate de timp, pentru o reacție de ordinul zero.
Timpul de înjumătățire Perioada de reacție de ordinul zero este direct proporțională cu concentrația inițială a substanței.
reacție de ordinul întâi
Viteza de reacție este descrisă de o primă ecuație cinetică ordine după cum urmează:
Constanta de integrare se determină din condiția: la t = 0 c = c0. atunci
Această ecuație poate fi scrisă în mod diferit
Se vede din ecuația că k1 dimensiune este independentă de concentrația expresiei. Dacă complotat împotriva ln c t, panta va determina constanta de viteză.
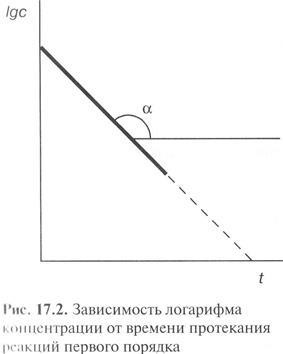
Jumătatea Termenul pentru o reacție de ordinul întâi
și nu depinde de concentrația inițială a reactanților.
reacție de ordinul doi
Viteza de reacție este determinată de ecuația cinetică de ordinul doi:
Dacă concentrațiile sunt egale
Din aceasta rezultă:
Separarea variabilelor și integrarea, avem
Constanta de integrare din condiția: la t = 0 c = c0
Dependența liniară a reacției de ordinul doi are loc în coordonatele 1 / s - t. Panta este constanta de viteză.
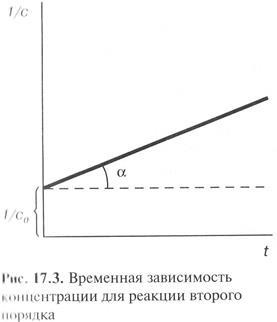
Jumătatea Perioada pentru a doua reacție comandă:
Jumătatea Perioada pentru o serie de reacții de ordinul doi este invers proporțională cu concentrația inițială a substanțelor.
Reacțiile celui de al treilea și superior ordinea sunt rare.