2.1.Tema: „Teoria structurii compușilor organici“
2.1.1. Principalele prevederi ale teoriei structurii compușilor organici și clasificarea compușilor organici.
1. Substanțe organice naturale și sintetice. Un pic de istorie a chimiei organice. Proprietățile generale ale substanțelor organice (compoziția, tipul legăturii chimice, structura cristalină, solubilitatea, raportul de căldură în prezența oxigenului și fără ea).
2. Teoria structurii compușilor AMButlerov organici. Dezvoltarea teoriei și semnificația acesteia.
3. Clasificarea substanțelor organice.
Denumirea substanțelor organice obținute, deoarece prima parte a acestui grup de substanțe studiate au fost o parte a organismelor vii. Cele mai multe dintre substanțele organice cunoscute în prezent nu sunt găsite în organisme vii, ele sunt preparate (sintetizat) în laborator. Prin urmare, se distinge substanțe naturale (organice) organic (chiar dacă majoritatea dintre ele pot fi acum obținute în laborator), iar substanța organică nu există în natură - substanțe organice sintetice. Ie numitele „substanțe organice“ istorice și speciale nu are nici un sens. Toți compușii organici sunt compuși de carbon. Substanțe organice includ compuși de carbon, cu excepția studiat în cursul Inorganic Chemistry substanțe simple de carbonil format, oxizii săi, acid carbonic și sărurile sale. Cu alte cuvinte: Chimie organica - Această chimie a compușilor de carbon.
O scurtă istorie a org.himii:
Berzelius 1827, primul manual de chimie organică. Vitaliștii. Doctrina „forță de viață.“
Primele sinteze organice. Wohler, 1824, sinteza acidului oxalic și a ureei. Kolbe, 1845 acid acetic. Berthelot, 1845 de grăsime. Butlerov, 1861 îndulcitor.
Dar, așa cum știința chimiei organice a început cu o teorie a structurii compușilor organici. O contribuție semnificativă la făcut de savantul german F.A.Kekule și Scot A.S.Kuper. Dar o contribuție decisivă aparține, fără îndoială, pentru chimistul românesc Butlerov.
Dintre toate elementele de carbon se distinge prin capacitatea sa de a forma compuși stabili, în care atomii sunt legați unul de altul în lanțuri lungi de diferite configurații (liniar, ramificat, închis). Motivul pentru această capacitate: aproximativ aceeași energie de legare C-C și C-O (pentru alte elemente ale energiei a doua - mult mai mult). În plus, carbonul poate fi într-una dintre cele trei tipuri de hibridizare, formând respectiv legături simple, duble sau triple, și nu numai între ei, ci și cu atomi de oxigen sau azot. Cu toate acestea, mult mai mare (aproape întotdeauna) atomi de carbon sunt conectate cu atomi de hidrogen. Dacă compoziția compusului organic conține numai carbon și hidrogen, compușii sunt numite hidrocarburi. Toți ceilalți compuși pot fi considerate ca derivați ai hidrocarburilor, în care unii atomi de hidrogen sunt înlocuiți cu alți atomi sau grupuri de atomi. Prin urmare, o definiție mai precisă: Compuși organici - sunt hidrocarburi și derivații lor.
Compuși organici mult -. Mai mult de 10 milioane (anorganica circa 500 mii.). Compoziția, structura și proprietățile substanțelor organice au multe asemănări.
Materialele organice au limitat compoziția calitativă. Necesar C și H, adesea O sau N, mai puțin halogeni, fosfor și sulf. Alte elemente fac parte din foarte rare. Dar numărul de atomi din molecula poate fi de până la milioane și greutatea moleculară poate fi foarte mare.
Structura compușilor organici. pentru că compozitie - nemetale. => Bonding chimică: covalente. Nepolar și polar. Ion este foarte rară. => Rețeaua cristalină molecular de multe ori.
Proprietăți fizice generale. punct de fierbere scăzut și de topire. Dintre substanțele organice au gaze, lichide și solide de topire scăzut. parte volatil poate avea un miros. De obicei, incoloră. Cele mai multe substanțe organice insolubile în apă.
Proprietăți chimice generale:
1) atunci când este încălzit fără accesul aerului toate „char“ substanțe organice, adică, în care carbonul format (mai negru) și alte substanțe anorganice. Există o ruptură de legături covalente, mai întâi polar, nepolare și apoi.
2) Atunci când este încălzit în prezența oxigenului, toate substanțele organice sunt ușor oxidate și astfel produsele finale ale oxidării sunt dioxidul de carbon și apă.
Caracteristici speciale ale reacțiilor organice. În reacțiile care implică molecule organice în timpul reacției ar trebui să rupă legăturile covalente sunt formate și altele. De aceea, reacțiile chimice care implică compuși organici sunt, de obicei, foarte lent, să le fie nevoie să se aplice temperatură ridicată, presiune și reacțiile anorganice katalizatory.V de obicei implică reacții de ioni apar foarte repede, uneori instantaneu, la temperatura normală. Reacțiile organice rareori conduc la randamente ridicate de produse (de obicei mai mic de 50%). Adesea, acestea sunt reversibile, în plus, poate curge nu una, ci mai multe reacții concurente unele cu altele, și, prin urmare, produșii de reacție va fi un amestec de compuși diferiți. Prin urmare, forma reacțiilor organice, de asemenea, este oarecum diferită. Ie nu utilizează ecuații chimice și scheme de reacții chimice în care nu prezintă factori, dar detaliile condițiile de reacție. De asemenea, este comună pentru a scrie o ecuație sub numele org. substanțele și tipul de reacție.
Dar, în general, substanțele organice și reacțiile generale sunt supuse legilor chimiei, iar substanțele organice sunt transformate în anorganic, sau pot fi formate din anorganic. Ceea ce subliniază încă o dată unitatea lumii din jurul nostru.
Principiile de bază ale teoriei structurii chimice a subliniat AMButlerov tineri oameni de știință la un congres internațional în 1861
1). Atomii din moleculele unite într-o anumită ordine, în conformitate cu valența lor. Secvență atomi compuși numiți structura chimică.
Valenței - este abilitatea de a forma un anumit număr de legături atomi (covalente). Valenței depinde de numărul de electroni neîmperecheați atomului elementului, deoarece legăturile covalente sunt formate prin perechi de electroni generale atunci când împerecherea electroni. Carbon în toate substanțele organice este tetravalent. Hidrogen - 1, oxigen -P, azot - SH, sulf - P clor - 1.
Metode imagine de molecule organice.
Formula moleculară - compoziția schematică a substanței. H2 CO3 - acid carbonic, C12 H22 O11 - zaharoză. Astfel de formule sunt convenabile pentru calcule. Dar ei nu dau informații despre structura și proprietățile materiei. Prin urmare, chiar și în materiile organice formula moleculară scrie mod special: CH3OH. Dar este mult mai probabil să utilizeze formulele structurale. Formula structurală a unui compus reprezintă ordinea atomilor în moleculă (adică, structura chimică). Și se bazează pe orice moleculă organică este un schelet de carbon - este un lanț legat de atomi de carbon legați covalent.
Moleculele electronice cu formula - legătură între atomii indicate în perechi de electroni.
Formula structurală completă a tuturor link-urile sunt afișate prin linii. Liantul chimică formată dintr-o pereche de electroni și se numește o singură formulă structurală este reprezentată de o liniuță. Dubla legătură (=) este format din două perechi de electroni. Triple (≡) este format din trei perechi de electroni. Iar numărul total al acestor conexiuni trebuie să respecte valența elementului.
Formula structurală a comprimat simplele legături cratimă omise și atomii legați la atomul de carbon sau diferiți, sunt scrise imediat după aceasta (uneori în paranteze).
Chiar mai multe reduceri sunt formule scheletice. Dar ele sunt folosite mai rar. De exemplu:
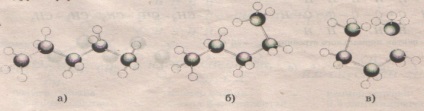
Formulele structurale reflectă doar ordinea de obligațiuni atomice. Dar moleculele organice rareori au o structură plană. imagine volumetrica a unei molecule este importantă pentru înțelegerea multor reacții chimice. molecula de imagine descrisă de termeni, cum ar fi lungimea legăturii și unghiul de legătură. În plus, este posibil să se rotească liber în jurul valorii de obligațiuni unice. Vizualizeazà furniza modele moleculare.