termodinamicii energie termică entropie
Prima lege a termodinamicii nu stabilește direcția proceselor termice. Cu toate acestea, experiența arată că multe procese termice pot avea loc într-o singură direcție. Astfel de procese sunt numite ireversibile. De exemplu, în contact termic între două corpuri cu temperaturi diferite ale fluxului de căldură este întotdeauna direcționată dintr-un corp cald la un cooler. Acesta nu a observat proces spontan de transfer de căldură din organism cu o temperatură scăzută la un corp la o temperatură mai ridicată. În consecință, procesul de schimb de căldură la diferența de temperatură finală este ireversibilă.
Procese numite tranziții reversibile ale unui sistem de la o stare de echilibru la altul, care pot fi efectuate în sens invers prin aceeași succesiune de stări de echilibru intermediare. În acest caz, sistemul în sine și corpul din jurul înapoi la starea inițială. Procesul prin care sistemul rămâne întotdeauna într-o stare de echilibru, cunoscut sub numele de cvasi-static.
Toate procesele cvasi-statice sunt reversibile. Toate procesele reversibile sunt cvasi-statice. Dacă fluidul de lucru al motorului termic este adus în contact cu un rezervor de căldură, temperatura în procesul de schimb de căldură rămâne neschimbat, este doar reversibil proces quasistatic izotermă care apare la o diferență infinitezimal de temperatură și rezervorul pentru fluidul de lucru. Dacă există două rezervoare de căldură cu temperaturi diferite pot fi realizate prin procese reversibile pe două porțiuni izolante. Deoarece procesul adiabatic poate fi efectuată și în ambele direcții (compresie adiabatică și expansiune adiabatică), procesul ciclic, constând din două izoterme și două adiabatic (ciclu Carnot) este singurul proces ciclic reversibil în care fluidul de lucru este în contact termic cu numai două căldură rezervoare.
Toate celelalte procese circulare efectuate cu două rezervoare de căldură, ireversibile. Irreversible sunt procese de conversie de lucru mecanic în energie internă a corpului, din cauza frecării, procesele de difuzie în gaze și lichide, gazul de proces de amestecare în prezența diferenței de presiune inițială, și așa mai departe. D. Toate procesele reale sunt ireversibile, dar poate în mod arbitrar îndeaproape apropie reversibil procese. procese reversibile sunt idealizare procesele actuale. Prima lege a termodinamicii nu se poate distinge reversibil de procese ireversibile. El cere pur și simplu anumit proces termodinamic nu vorbește de balanța energetică și afirmația că un astfel de proces este posibil sau nu.
Direcția de procese care au loc în mod spontan stabilește a doua lege a termodinamicii. Acesta poate fi formulat sub forma unei interdicții asupra anumitor tipuri de procese termodinamice. Fizicianul englez William Kelvin a dat în 1851 formularea celei de a doua lege. In operare ciclic procesul motor termic nu este posibil, singurul rezultat care ar fi transformată în lucru mecanic al întregii cantități de căldură obținută dintr-un singur rezervor termic. motor termic Ipotetic, care ar putea fi un proces care se numește „mașină de mișcare perpetuă de al doilea tip.“ În condiții terestre, această mașină ar putea selecta energia termică, de exemplu, oceanele și transforma într-un complet de lucru.
Masa apei în oceane este de aproximativ 1021 kg, și cum se răcește la un grad pentru a evidenția o mare cantitate de energie (# 63 1,024 J) echivalent cu 1017 kg de arderea completă a cărbunelui. generată anual de energie pe Pământ de aproximativ 104 de ori mai puțin. Prin urmare, „o mașină de mișcare perpetuă a doua natură“ ar fi omenirea nu mai puțin atractiv decât „mașină de mișcare perpetuă a primului tip“, a interzis prima lege a termodinamicii. fizicianul german R. Clausius a dat o altă formulare a doua lege a termodinamicii: Nu se poate procesa doar rezultatul care ar fi transferul de energie prin transfer de căldură din organism, cu o temperatură scăzută la un corp la o temperatură mai mare. Fig. 1 prezintă procese interzise drept a doua, dar nu este interzis de prima lege a termodinamicii. Aceste procese corespund celor două formulări din a doua lege a termodinamicii.

Figura 1 Procesele care nu contravin prima lege a termodinamicii, dar interzise de-a doua lege:
1 - „o mașină de mișcare perpetuă de al doilea tip“; 2 - transferul spontan de căldură de la un corp rece la un cald ( „aparat frigorific ideal“).
Trebuie remarcat faptul că atât modul de redactare a doua lege a termodinamicii sunt echivalente. Dacă presupunem, de exemplu, că căldura poate în mod spontan (adică fără costurile de muncă externe) să treacă în timpul transferului de căldură de la un corp rece la un cald, puteți veni la o concluzie cu privire la posibilitatea de a crea o „mașină de mișcare perpetuă de al doilea tip.“ Intr-adevar, lasa un motor termic real, primește de la sisteme de încălzire de căldură cantitatea Q1 și Q2 dă cantitatea de căldură frigider. Atunci când se face acest lucru A = Q1 - | Q2 |. În cazul în care cantitatea de căldură | Q2 | a trecut spontan de la răcitorul de la încălzitor, rezultatul final al unui motor termic reală și „mașină de răcire ideală“ ar fi transformarea activității cantității de Q1 căldură - | Q2 |, obținute de la sistemul de încălzire fără nici o schimbare în frigider.
Astfel, combinația de motor termic reală și „răcitorul de lichid ideal“ este echivalent cu „o mașină de mișcare perpetuă de al doilea tip.“ În mod similar se poate demonstra că o combinație de „Chiller reale“ și „mașină de mișcare perpetuă de al doilea tip“ este echivalent cu „răcitorul de lichid ideal“.
A doua lege a termodinamicii este conectat direct la ireversibilitatea proceselor termice reale. Energia mișcării termice a moleculelor calitativ diferite de toate celelalte forme de energie - .. mecanice, electrice, chimice, etc. Energia oricărei forme, pe lângă energia mișcării termice a moleculelor, poate fi transformat complet în orice alt tip de energie, inclusiv energia mișcării termice. Acestea din urmă pot experimenta de conversie la orice alt tip de energie doar parțial. Prin urmare, orice proces fizic în care conversia oricărui tip de energie la energia mișcării moleculare termică este ireversibilă, adică nu poate fi realizată în întregime în sens invers. O trăsătură comună a tuturor proceselor ireversibile este ca acestea să aibă loc într-un sistem termodinamic neechilibru și, ca urmare a acestor procese un sistem închis se apropie de starea de echilibru termodinamic.
Pe baza oricăreia dintre formulările din a doua lege a termodinamicii, următoarele afirmații pot fi dovedite, numit teorema Carnot:
1. Eficiența unui motor termic, care funcționează la valori date ale temperaturii încălzitorului și mai rece, nu poate fi mai mare decât eficiența mașinii, care funcționează pe ciclul Carnot reversibil cu aceleași valori ale încălzitorului și temperaturi mai scăzute.
2. Eficiența unui motor termic care funcționează în conformitate cu ciclul Carnot, nu depinde de tipul de fluid de lucru, dar numai la temperatura încălzitorului și răcitorul.
Astfel, eficiența mașinii, care funcționează pe ciclul Carnot este maxim.
Egalitatea în această relație corespunde ciclurilor reversibile. Pentru mașinile care rulează pe ciclul Carnot, acest raport poate fi rescrisă ca
În orice direcție ciclu Carnot a costurilor (sensul acelor de ceasornic sau invers acelor de ceasornic), valorile Q1 și Q2 întotdeauna au semne opuse. Prin urmare, putem scrie
Această relație poate fi generalizat la orice proces reversibil închis care poate fi reprezentat ca o serie de mici izotermă și secțiuni adiabatice (Fig. 2).

Figura 2. Un ciclu reversibil arbitrar ca o serie de izotermă mici și secțiuni adiabatice
Un crawl plin închis ciclu reversibil
în care DQi + = DQ1i DQ2i - cantitatea de căldură produsă în organism de lucru parcelele două temperaturi izotermă Ti.
Pentru a efectua un astfel de mod reversibil ciclu de complicat, fluidul de lucru trebuie să rezulte în contact termic cu un număr de rezervoare de căldură cu temperaturi Ti. DQi / raportul Ti numit căldură redusă. Ecuația rezultată arată că căldura totală dată oricărui ciclu reversibil este zero. Această formulă ne permite să introducem o nouă cantitate fizică numită entropie și notate cu litera S (R. Clausius, 1865). Dacă sistemul termodinamic se mută de la o stare de echilibru la altul, care se schimbă entropia lui. Entropia diferență în cele două state este dată de căldură primită de sistem într-o tranziție reversibilă de la un stat la altul.
În cazul procesului reversibil DQi adiabatic = 0 și, prin urmare, entropia S rămâne neschimbată. Expresia pentru Ds schimbare de entropie în tranziția de la un sistem de echilibru neizolat (1) într-o altă stare de echilibru (2) poate fi scrisă ca
Entropia este determinată până la un termen constant, precum și, de exemplu, energia potențială a unui corp în câmpul de forță. Sensul fizic al dS entropiei este diferența în cele două stări ale sistemului. Pentru a determina modificarea entropiei în cazul unei tranziții ireversibilă a unui sistem de la un stat la altul, trebuie să se gândească la un proces reversibil care leagă stările inițiale și finale, precum și pentru a găsi căldura redusă generată într-un astfel de sistem de tranziție. Fig. 3 ilustrează expansiunea ireversibilă a gazului „în gol“, în absența căldurii. Numai starea inițială și finală a gazului în acest proces sunt în echilibru, și poate fi reprezentată în diagrama (p, V). Literele (a) și (b), care corespunde acestor state se află pe aceeași izotermă. Pentru a calcula Ds variația de entropie este posibil să se ia în considerare o tranziție izotermă reversibilă de la (a) la (b). Deoarece expansiunea izoterma a gazului primește o anumită cantitate de căldură din jurul corpurile Q> 0, se poate concluziona că expansiunea ireversibilă a crescut entropia gazului: dS> 0.
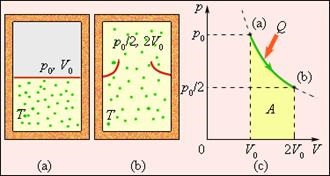
Figura 3. Extinderea de gaz într-un „vid“. Modificarea entropie
unde A = Q - gaz de lucru într-o expansiune izotermă reversibilă.
Un alt exemplu al unui proces ireversibil - căldură pentru o diferență de temperatură finită.
Fig. 4 prezintă două corpuri închise de coajă adiabatic. T1 inițială a temperaturii corpului și T2
Creșterea entropiei este o proprietate generală a tuturor proceselor ireversibile care apar spontan în sistemele termodinamice izolate. În procesele reversibile entropia rămâne neschimbată în sisteme izolate:

Figura 4. Schimbul de căldură la diferența de temperatură finită: a - starea inițială; b - starea finală a sistemului. Schimbarea în dS entropiei> 0.
Acest raport se numește legea entropiei. Dacă orice procese în sistemele izolate termodinamice entropie, fie rămâne aceeași sau crește. Astfel, entropia indică direcția proceselor care au loc în mod spontan. Creșterea entropiei indică abordarea sistemului la o stare de echilibru termodinamic. La echilibru, entropia este maximă. Legea creșterii entropiei poate fi luată ca o altă formulare a doua lege a termodinamicii. În 1878 Boltzmann a dat o interpretare probabilistică a entropiei. El a propus să ia în considerare entropia ca o măsură statistică de tulburare într-un sistem termodinamic închis. Toate procesele care au loc în mod spontan într-un sistem închis, aduce sistemul la o stare de echilibru, și însoțită de o creștere a entropiei, sunt îndreptate spre creșterea probabilității statului. Orice sistem macroscopic condiție care cuprinde un număr mare de particule poate fi realizată în mai multe moduri.
Termodinamic probabilitate W sistemul de stat - este numărul de moduri în care acest sistem macroscopic de stat, sau numărul de performante microscopice acest macrostări pot fi puse în aplicare. Prin definiție, termodinamică probabilitate W >> 1. De exemplu, în cazul în care nava este de 1 mol de gaz, un număr mare de moduri posibile de N molecule care introduc două jumătăți ale navei:
Numărul lui Avogadro undeva. Fiecare dintre ele este un microstare. Numai unul dintre microstările cazului în care toate moleculele se adună într-o jumătate (de exemplu, dreapta) al vasului. Probabilitatea unui astfel de eveniment este aproape de zero. Cel mai mare număr de microstările corespunzătoare stării de echilibru în care moleculele sunt uniform distribuite de volum. Prin urmare, starea de echilibru este cel mai probabil. Starea de echilibru a de altă parte, se află în stare de cea mai mare tulburare de sistem termodinamic și starea entropia maximă. Conform sistemului de entropie S Boltzmann și probabilitatea termodinamică W legat după cum urmează:
unde k = 1,38 · 10-23 J / K - constanta Boltzmann. Astfel, entropia este determinată de logaritmul microstările numerice prin care acest lucru poate fi realizat macrostări. Prin urmare, entropia poate fi considerată ca o măsură a probabilității stării unui sistem termodinamic. Probabilistic interpretare doua lege permite abaterea de la sistem spontan de echilibru termodinamic. Aceste abateri sunt numite fluctuații. În sistemele care conțin un număr mare de particule, o deviere semnificativă de la starea de echilibru sunt probabilitate extrem de mici.