Chimie și Inginerie Chimică
Pentru metal bivalent ion electrochimie amalgam proces de evacuare a metalului dintr-o soluție cu o activitate de L-5-10- mol la o temperatură de 293,2 K dependență există [c.115]
Mecanismul de ionizare etapizat afectează în mod semnificativ forma curbelor de polarizare ucrainiano. în cazul în care, ca urmare a acestei nu există una, ci mai multe Tafel parcele cu diferite pante. Luați în considerare ecuația și curba de polarizare corespunzătoare în ceea ce privește cel mai simplu caz al procesului de ionizare în două etape, având drept rezultat final formarea ionilor metalici bivalenți în soluția ecuației (8.11). Să o și P - pentru coeficienții de transfer, h metal monovalent ion în conversie și conversia inversă. o „și P“ - aceiași coeficienți pentru trecerea unui ion monovalent și o divalent și procesul invers. [C.199]
Rețineți că în stabilizarea câmpului de cristal (zero liganzi) - acesta este doar unul dintre factorii care asigură stabilitatea complexelor de metale de tranziție. Fig. 23 prezintă datele experimentale privind căldurile de apă de hidratare complexe bivalenți și trivalenți ionii din prima perioadă lungă [164, 166, 170]. Puncte (cruci) aranjate curba pas cu două maxime și minime pe + Mn și Fe +. În cazul în care energia de scădere de stabilizare a câmpului cristalin. valori corectate (puncte închise) vor fi amplasate pe curba netedă. ridicându-se la sfârșitul perioadei. Această contribuție principală la stabilitatea complexului este determinată de atracția liganzilor la miezul sferice ion simetrie metal. Aceasta crește cu scăderea de încărcare și raza de ioni. Ordinea de stabilitate a complexelor de ioni metalici bivalenți ai primei perioade lungi aproape toți liganzii [164] crește în număr Mn> Zn +. [C.52]
Mult mai sunt disponibile date pentru atomii de comparație ale donatorilor, cum ar fi azot, oxigen și sulf. Schwarzenbach și colaboratorii [274] Constantele de stabilitate definite pentru complexele de un mare număr de ioni metalici bivalenți cu liganzi polidentați de tip I (Y = NMe, O sau S) [c.57]
În unele cazuri, chelare îmbunătățește separarea. Astfel, pentru a precipita hidroxizi de fier, aluminiu, crom și altele. D. amoniac pe scară largă folosit ca posibilitatea de a co-precipitarea ionilor metalici bivalenți, cum ar fi cupru, nichel, cobalt, zinc și așa mai departe. G. este minimizată datorită capacității lor de a forma complexe de amoniac . [C.303]
Elemente Jumătate din M + / M și M + / M-Hg au fost utilizate pentru a studia complecșilor unor ioni metalici, care sunt prezentate în tabel. 7-1 sunt multe alte exemple de utilizare a electrozi metalici și din amalgam sunt date în [38, 39]. In cele mai multe cazuri, metalul M este un element din grupa de tranziție a tabelului periodic. Amalgam principalele metale din grupa a grupelor 1 si 2 sunt descompuse de apă și nu sunt utilizate pe scară largă pentru studiul echilibrului. Cu toate acestea curg electrozi din amalgam poate fi folosit pentru soluții apoase [114]. Joseph [120] au studiat interacțiunea proteinelor cu calciu folosind electrod amalgam. protejate de soluție cu o pungă de plastic. Comportamentul de metal electrozi amalgam, și se supune ecuația (7-3), până la concentrațiile de ioni metalici de 10 -10 M, dar utilizarea acestei ecuații în soluții mai diluate conduce la erori. Limita superioară a concentrației pentru care ecuația observată (7-3) este determinată de faptul că este imposibil să se mențină o activitate constantă coeficienți ale marilor schimbări ale tăriei ionice. Astfel, ecuația (7-3), se aplică soluții de ioni (LM) + Vi (3 -2 M) și SYU4 (ZM) numai în regiunea 6 0,01M la ionii metalici bivalenți și o regiune 6 Zn. Această secvență este rupt pentru numere de coordonare mai mare de patru, - în parte datorită faptului că ionii de cupru si zinc tind să formeze doar patru legături de coordonare cu toți liganzi, cu excepția apei. De obicei, C> Y1> 2n, dar în complexe cu liganzi având o grupare gidrilnuyu sulfit, 2n este mai activ, și ia forma unei secvențe de C> 2n> M1. [C.403]
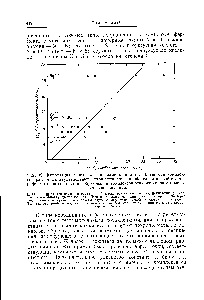
FIG. 79. Corelația dintre logaritmii constantele de stabilitate ale complexelor de diferiți ioni metalici bivalenți cu carboxipeptidază și logaritmii primelor constantele complexare a ionilor cu compușii de model.
Capacitatea de schimb de schimbători de ioni depinde de tipul de contor. De exemplu, carboxil cationice ionilor metalici bivalenți mai ușor sorbită decât monovalent. Această specificitate este definită ca o selectivitate termodinamic și a capacității de schimb. Pentru a evalua efectul pH-ului asupra capacității de schimb de ioni metalici bivalenți este convenabil să se utilizeze [144] Raportul [c.67]
Regiunea Cantitativ prost inteleasa rămâne ioni polivalenți sorbție substanțelor organice. Este cunoscut faptul că sorbția ionilor metalici bivalenți în schimbul monovalent însoțită adesea de o creștere a entropiei [206]. Sa presupus că apar două microstare pentru ionii bivalenti, spre deosebire de una pentru perechea de microstare monovalent. reprezentărilor model pentru o astfel de sorbție necesită introducerea unui număr de rezerve. În primul rând, trebuie să rezinaților pentru ionii monovalenți au fost identice. Schimbul de ioni este de a avea loc echivalența legilor. Ionul bivalent în schimbătorul de ioni trebuie să fie caracterizat prin cel puțin două microstările energetice, care pot fi reprezentate ca și stările posibile ale unei energii mari datorită unei energii de ioni fixă și scăzută datorită celeilalte părți, în conformitate cu restrângerea mobilității structurii cu ochiuri schimbător de ioni. [C.116]
ioni de staniu (P) și staniu (1U) se comportă într-un mod particular de rășină iminodiacetic monofuncțional. Deși comportarea la temperatura camerei ionilor Sn este un comportament normal al ionilor metalici divalenți, îndepărtarea urmelor de staniu monofuncțional rășini iminodiacetic (și, de asemenea, alte rășini Helon) sunt aproape imposibil, deoarece rășina rămâne întotdeauna urme de produse de hidroliză. Cele mai bune aceste urme pot fi eluate la temperaturi scăzute, acizi, agenți de complexare sau soluție polisulfură. La temperaturi ridicate. cu toate acestea, precipitată hidrat de oxid de staniu este deshidratat, astfel încât orice îndepărtare este de neconceput. Dacă oricare nu ar exclude prezența unei sări de staniu sau o urmă, ar trebui să se ia în considerare aceste fapte. [C.136]
Distribuția normală. când toți ionii metalici divalenți sunt în pozițiile A-M + [Ms +] X4. [C.5]
ion metalic încărcat separat M + este selectat pentru a simplifica ecuațiile. iar această alegere nu înseamnă că astfel de ioni sunt extrase mai ușor. Din cauza motivelor discutate în articolul următor, unii complecși ai ionilor metalici trivalenți și bivalenți sunt extrase mai ușor. [C.258]
Tabelul include constantele de electroni rata de captare a ionilor metalici bivalenți hidratate. Atunci când acestea sunt utilizate ca acceptori de electroni de captare duce la apariția ionilor monovalenți. sunt adesea instabile în soluție sau pe suprafața electrodului. De exemplu, în soluții RR +, C (1 + și Cu + photocurrents vanishingly mici în toată gama de măsurare disponibile potențialelor (de potențialul prag la potențialul de reducere întunecată a ionilor metalici bivalenți pe mercur.) Evident, ionii monovalenți ai acestor metale sunt oxidați rapid la electrod. dar, chiar dacă, de exemplu, și C (1 + nu dau propria lor fotocurentul, nu interferează cu măsurarea constantelor de viteză de captare a electronului hidratat acceptors concurente pe metoda descrisă mai sus. în contrast, fotocurent vizibile observate în p astvorah N1 + și Mn +, așa indică oxidarea lentă a N1 + și Mn + pe un electrod de mercur în intervalul potențial studiat [25]. [c.134]
Mecanismul de ionizare etapizat skazyvaetsy substanțial pentru a forma curbelor de polarizare. în cazul în care, ca urmare a acestei există nici una, ci secțiuni cu pante diferite de mai multe Tafel-ing. Considerăm ecuația și polarizarea sa corespunzătoare, curba în ceea ce privește cel mai simplu caz al procesului de ionizare în două etape, având drept rezultat final formarea ionilor metalici bivalenți în soluția ecuației [c.113]
Hidroxichinolină (oxină) este utilizat pentru determinarea greutății multor metale. Prepararea complexelor de compoziție definite strict Mg (cu număr de coordinare a ionului metalic, n = 4), Mz (când n = 6) și ML4 (când n = 8), după uscare permite utilizarea de către oxinate adecvate ca forme de greutate. Dintre ionii metalici bivalenți care formează complecși insolubili de tipul celor pentru care Mg și determinarea greutății eventual folosind această metodă, este posibil să se specifice Mn2 + Co +, N 2+, Cu +, CC12 +, ionii de Pb +, etc-A1 +, Pd +, B1 + formă complexe insolubile tip miz și Th + tip și ML4. Includerea unui număr mai mare de liganzi în complexele oksynatnye reduce semnificativ factorii de conversie pentru oxinate metalic corespunzător utilizând ca forme ponderate. De exemplu, pentru 2m complex [Ox] 4 [c.222]
căldura totală a altor ioni metalici hidratării AGN (M) sunt bine cunoscute [131, 242] și intervalul -100--1,500 kcal / mol. Williams [309] a arătat că 18 valori pentru ionii metalici bivalenți pot fi transferate prin ecuația empirică [C.37]
Pentru complexele de complecși tetraedrice low spin și raționamentul oarecum diferit, dar secvența DYagaz prezis în aceste cazuri se caracterizează configurația nod nalichtsem când un ion metalic d, [114]. formule magice Valorile AYagaz -mini Pentru a forma ioni metalici bivalenți din prima tranziție a fost calculată folosind ciclul Haber - Born [68, 115] și sunt în concordanță cu secvența prezisă a același lucru este valabil și pentru valorile D Hydr (M) pentru acești ioni metalici [131] (Figura . 3). Scăzând stabilizare orbital (care poate fi calculată din spectrele de absorbție în regiunea vizibilă), din entalpia totală schimbă poluchayut- [C.38]
Logaritmii constantele de stabilitate ale complexelor cu același ligand pentru lantanide și metalele de tranziție sunt mai întâi în dependența explicită de numărul atomic al ionului metalic central. Datorită acestei serii de compresie lanthanoid asemenea dependență funcție echivalentă de 1 / Hz (vezi. Secțiunea V, 1). Multe dintre datele disponibile pentru 1952 F. Pentru complexele de ioni metalici bivalenți ai primei perioade de tranziție au fost revizuite Irving și Williams [142]. Valorile lgiG sau 1DR (n 2n. Se observă aceeași procedură. După cum sa arătat mai târziu, și pentru un număr de liganzi cu atomi de sulf donor [144, 180a, 283]. Au definit recent acetat de stabilitate [315], o-alanină [115, 313 ] și etilendiamină [2251 complecși de Cr (II), și a găsit ordinul Cr> Mn (Fig. 8). în plus, în absența unor câmpuri tetragonale puternice sau pentru k> 4 ordine inversă a găsit N1> C [32, 313]. [c.51 ]
ioni metalici bivalenți, inclusiv ionii de cobalt este separat de fier (P1) în sistemul ICF - HK1 ultimul eluat cu 0,5 M H I [66]. Același sistem pentru separarea Co (II) și Fe (în) utilizat Preobrazhenskii și colab. [81]. Descrie o metodă de separare a fierului (III) din diferitele elemente din sistemul de 2-octanonă - HK1 [41]. Mikulski și colab. [67] au identificat mai multe [c.247]
Într-un cristal ionic proprietăți electrice speciale nu au numai locuri de muncă, ci și impuritățile, în special încărcat impurități substitutionali. Rolul lor este jucat de ioni metalici bivalenți adesea înlocuind cationi punctul defect O astfel de rețea. în mod natural, posedă, de asemenea, energia Coulomb redundante. ci pentru că este benefic pentru echipa cu un post vacant de cationi încărcat negativ. Nu este greu de înțeles că, în proprietățile sale electrice pereche de post vacant de impuritate, diferă puțin de divacancies discutate mai sus. Cu toate acestea, deformarea locală a cristalului, precum și posibile orientări dipol în rețeaua cristalină, altele decât divacancies. Acestea din urmă trebuie să fie cel puțin din faptul că atât defectul (o impuritate încărcată și post vacant) sunt situate în același sublatice ion. [C.181]
Ferocen - doar unul dintr-un număr mare de compuși ai metalelor de tranziție. care includ ciclopentadienil ani-unu. Printre metalele. formând zhtaldotseny sau structură de tip sandwich cu rrotsenu similare includ nichel, titan, cobalt, ruteniu și osmiu. Metalocenii Stabilitate variază în funcție de metalul și starea de oxidare sunt cele mai stabile ferocen, osmocene ruthenocene și astfel, în acești compuși, ionul metalic bivalent capătă o configurație electronică a unui gaz inert. [C.232]
diamtomită devine hidrofob în formarea insolubili săpun metalic și suprafața de silice [57]. De exemplu, dioxid de siliciu tratat cu hidroxid de calciu sau hidroxid de bariu sau carbonat de magneziu bazic pentru a produce un strat de silicat insolubil. care, la rândul lor, tratate cu săpun. Ionul metalic bivalent se leagă. Suprafața kre.mnezema evident acid gras. stearat de clorură de crom adsorbiți ireversibil th e, pentru a forma un monostrat pe suprafața de silice, făcându-l foarte hidrofobi. [58] În această po- [c.242]
Deoarece este abilitatea de a forma un legături suficient de puternice cu proteine și alți polimeri. cum ar fi celuloza, pectina, tanin este principala diferență de ceilalți compuși fenolici. de interes rasslyutret pe scurt aceste conexiuni. Taninuri sunt capabili să formeze trei tipuri de comunicare, în primul rând, posibile legături de hidrogen între grupările hidroxil fenolice ale tanin și grupările amino libere și grupările amidice ale proteinei. grupări hidroxil sau carboxil și alți polimeri în al doilea rând posibile legături ionice între grupuri încărcate corespunzător anionici tanin și grupe cationice ale proteinei sau, în cazul altor macromolecule. obrazovapie săruri, eventual amestecate cu ionul metalic bivalent corespunzător, cum ar fi calciu, în final, în al treilea rând, posibile legături covalente. formate prin reacția dintre grupări -Noi sau semiquinone Quino care pot fi prezente în taninuri, cu grupul reaktsiopnosposobnoy adecvat în moleculă de proteină sau un alt polimer. Odpako primele două tipuri de comunicare, desigur, stabilitate ușor de rupt de orice complex format prin astfel de conexiuni, aceasta depinde nu numai de concentrația de tanin și polimer otnosite.yanyh care participă la reacție, și la pH-ul soluției tărie ionică. precum prezența reactanților. distrugând legăturile de hidrogen. sau un metal capabil să formeze chelati. Pe de altă parte, capacitatea de taninuri pentru a forma covalente stabile [c.330]
Acesta Din [etit că ionii metalici bivalenți au diferite tendința de a forma complecși de tipul 1 2. [c.98]
Dacă un amestec de ioni metalici bivalenți adsorbit pe o rășină iminodiacetic monofuncțional. și apoi coloana a fost eluată în acizi minerali diluați. fiecare poyavlya- ion [c.112]