În chimie, concentrația - o cantitate ce caracterizează compoziția cantitativă a soluției.
Mai multe tipuri de descriere matematică sunt următoarele: concentrația de masă, concentrația molară, kontsentratsiyai concentrație în vrac. Concentrația Termenul poate fi aplicată oricărui tip de amestec chimic, dar cel mai mult se referă soluților și solvenții în soluție. Molar (suma) concentrarea opțiunilor, cum ar fi concentrația normală și concentrația osmotică.
descriere calitativă

Concentratiile adesea se face referire la niveluri care reflectă nivelurile circuitului mental de-a lungul axei verticale din grafic care poate fi ridicată sau scăzută (de exemplu, „niveluri serice ridicate ale bilirubinei.“ - concentrația bilirubinei în serul sanguin, care sunt mai late decât în mod obișnuit.).
Concentrația soluției depinde schimbarea volumului cauzată în principal de dilatare termică.
desemnarea cantitativă
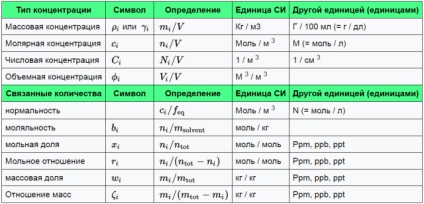
Există patru valori care descriu concentrația de:
Densitatea în vrac este definită ca masa subiectului împărțită la volumul amestecului:
SI este kg / m3 (egal cu T / A).
Concentrația molară a elementului constitutiv se determină ca sumă (în moli) la volumul amestecului:
SI este mol / m3. Cu toate acestea, este folosit mai des unitatea mol / l (= mol / dm3).
Cantitatea de concentrație definită ca numărul de persoane în amestec supus volumul amestecului:
IS este de 1 / m 3.
Concentrația de volum este definit ca volumul unui subiect împărțit la volumul amestecului:
Fiind adimensionala, este exprimată ca număr, de exemplu. 0,18 sau 18%; Unitate-1 sa.
valorile aferente
O serie de alte valori pot fi utilizate pentru a descrie compoziția amestecului.
Normalitatea este definită ca fiind concentrația molară împărțită în factorul de echivalență. Deoarece definiția factorului de echivalență depinde de contextul (care este studiat reacția), IUPAC și NIST descurajează utilizarea normalității.
Molalitate (a nu se confunda cu un molar)
Molalitate soluției este definită ca fiind cantitatea de component (alunițe B), împărțit la greutatea solventului (nu greutate soluție):
Unitatea SI pentru molaritatea egală mol / kg.
Fracția molară este definită ca fiind cantitatea de (B moli) componente împărțit la numărul total al tuturor componentelor din amestec.
Unitatea SI - mol / mol. Cu toate acestea, denumirile cu frecvență redusă în vârstă sunt adesea utilizate pentru a descrie fracții molare mici.
Raportul molar este definit ca suma componentei împărțită la cantitatea totală a tuturor celorlalte componente din amestec:
Dacă mult mai mică decât raportul m Aulnay este aproape identic cu fracția molară.
Unitatea SI - mol / mol. Cu toate acestea, părțile desemnează depășite sunt adesea folosite pentru a descrie valori mici ale rapoarte molare.
fracție de masă - fracțiune dintr-o substanță cu o masă la masa întregului amestec. Acesta este definit ca:
Unitatea SI este kg / kg. Cu toate acestea, părțile inutilizabile pentru a desemna adesea utilizat pentru a descrie fracțiuni de masă mici.
Raportul masic este definit ca greutatea ELENITE d component față de greutatea totală a tuturor celorlalte componente din amestec:
Dacă mult mai puțin decât. Raportul de greutate este aproape identică cu o fracție de masă.
Unitatea SI - kg / kg. Cu toate acestea, moștenirea denumirile sunt adesea folosite pentru a descrie rapoartele de masă mici.
Concentrațiile de masă și de valori asociate
Soluții - un subiect de studiu.