Pe măsură ce virusul intră în celulă
Yuri Alexandrovich Chizmadzhev, Corr. Academia rusă de Științe, d. X. n. prof. Departamentul de Biofizică USM,
Șef al Laboratorului Institutului de Electrochimie bioelectrochimie im.A.N.Frumkina RAS.
După cum se știe, celula conține un număr mare de structuri membranoase - de vezicule izolate la o rețea continuă de reticulului endoplasmatic. Și întregul sistem este într-o stare constantă de restructurare, care include mai multe acte de fuziune și fisiune. Deci, în proteina aparat Golgi ambalate în recipiente de vezicule, care fuse cu membrana plasmatică. Aceasta completează procesul de exocitoză. Un alt exemplu - fuziunea cu membrana si vezicule secretorii neurotransmițători sinaptici, și prin transmiterea impulsului nervos se produce, unul dintre purtătorii primare de informații.
Livrarea de particule mari se realizează în celulă prin endocitoză. Celula ingerează particule din mediul înconjurător, care sunt invaluite de porțiunea de membrană plasmatică este formată cav, țesătura este distrusă, iar recipientul este in interiorul celulei. Dezasamblarea - asta e altă poveste, și trebuie să subliniem faptul că endocitoză și exocitoză sunt mediate printr-o varietate de proteine, a căror natură și mecanismul de acțiune nu este complet instalat.
În plus față de „util“ fuzionează cu celule tot timpul trece printr-o fuziune de cazuri „dăunătoare“. De exemplu, atunci când a ataca virusul, care este suficient pentru a spune: „! Deschideți susan“, și o membrană lipidică a siguranțelor virusului cu membrana plasmatică. Aceasta formează așa-numitul timp pentru a fuziunii, iar ADN-ul viral sau ARN incepe in interiorul celulelor gazda. În corectitudine trebuie remarcat faptul că capacitatea unică de viruși de a „seifuri deschise“ au fost utilizați în beneficiul organismului. In terapia genica virusurile inofensive pick-biscuiti, care coase o gena util care ajuta o celulă bolnavă.
Pentru a înțelege mecanismul fizic al fuziunii obiectelor biologice este extrem de dificil. Ca întotdeauna în astfel de cazuri veni în ajutorul sistemelor de model. Referindu-se la trecutul recent, trebuie subliniat faptul că la mijlocul anilor 80 au fost realizate câștiguri impresionante în studiul mecanismului de fuziune a lipidelor bilayers [1]. Cu toate acestea, pe la mijlocul anilor 90 a relevat: intermediari ai procesului de luat în modelele teoretice, au energie de mare, astfel încât viteza de proiectare, contrar datelor experimentale, este neglijabilă. În plus, deși sa demonstrat că proteinele speciale joacă un rol-cheie în fuziune, aceasta nu a fost clar ceea ce fac. Rezolvarea acestor probleme au fost dedicate muncii experimentale si teoretice ale laboratorului nostru, realizat în a doua jumătate a anilor '90.
Calea virusului în celulă
Virusul mondial este foarte diversă. Comun pentru ei este că orice material genetic (sub formă de ADN sau ARN) sunt atent ambalate în costum de protecție a proteinelor. Particulele virale (virioni) diferă în formă și dimensiune. Astfel, diametrul virionii sferice - 20-300 nm. Unele virusuri au un înveliș lipidic suplimentar, care include proteine specializate care promovează membrana de fuziune. Astfel de virusuri sunt numite invaluit. o lipidă-proteină plic cerințe duble. Pe de o parte, acesta trebuie să protejeze materialul genetic de vicisitudinile vieții, dar pe de altă parte - este ușor să se prăbușească atunci când virusul începe viața activă în celulele victimei.
virusurile încapsulate intra în celulă în două moduri. În primul caz, virusul se leaga de receptorii celulari de suprafață, apoi, ca urmare a endocitoză, vezicule conținând virion bud. In aceasta stare, virusul este ambalat într-o carcasă suplimentară formată prin membrana celulară. Din a doua carcasă, atunci când acesta este eliberat de la confluenta endosome veziculă, în care mediul acid activează proteinele de fuziune și contribuie astfel la unificarea cu membrana endosomală a virionului. Ca urmare, materialul genetic pătrunde în citoplasmă și se poate ajunge la miez. În primele etape ale acestui proces, inclusiv penetrarea în endozomul, virusul joaca un rol pasiv. Acesta utilizează mecanismul normal al endocitozei, și de încredere celula nici măcar nu știe ce pericolele de acest „dar al sorții.“ Și doar o singură dată în endozomul, virusul este activat și ia jocul de peste, cauzând fuziunea membranelor lor cu membrana endosomală. Acesta acționează ca un virus gripal bine-cunoscut.
Două căi invaluit de penetrare a virusului în celulă.
Stânga - endocytosis și fuziune în endosome 1 - virus, 2 - endozomul, 3 - miez.
Dreapta - fuziunea cu membrana plasmatică.
Alte virusuri, cum ar fi virusul imunodeficienței umane (HIV), nu este nevoie să activeze la pH scăzut și pătrunde în celulă într-un mod mai simplu, în care cochilia fuziona imediat cu membrana plasmatică, iar materialul ereditar este o celulă. Acum, el poate ajunge doar la miezul.
Astfel, în orice caz, un eveniment cheie în lupta învelită virus cu o celulă - fuzionarea anvelopanta lipidelor din membrana plasmatică sau lizozomale. Este această etapă crucială a infecției de celule și este dedicată poveștii noastre. Mai exact, ne vom concentra asupra virusului gripal A. Datorită particularităților structurii lor, a fost obiectul cel mai convenabil pentru studiul experimental al mecanismului de fuziune.
Acest virus încapsulat are o formă aproximativ sferică, cu un diametru de aproximativ 0,13 microni. În partea centrală există un număr de molecule de ARN si proteine necesare virusului în primele stadii ale vieții într-o cușcă. Nucleul virionului este înconjurat de un înveliș de proteine M1, în spatele ei este o membrană lipidică. coajă de proteine, încastrate în membrana lipidică, se aseamănă cu o plasă de pescuit, care este montat pe picioroange. Dimensiunea celulelor din rețeaua de proteină de aproximativ ¥ 4 4 2. nm, astfel încât o astfel de mare „pește“, ca un complex de ARN-proteine pentru a trece prin ele nu pot. Plicul lipidic este format din membrana plasmatică a celulelor infectate cu virusul de înmugurire sintetizat. In aceasta proteina ancorat trei membrane: neuraminidaza (N), canalul ionic M2 și hemaglutinina (HA). Când acidifierea mediului prin canalul ionic în interiorul virionului este redus pH-ul, ceea ce duce la distrugerea învelișului proteic M1. În același timp, activează hemaglutininei, componenta principală a „fuzionează mașinii.“ În cursul activității sale membrana virală și celulele sunt închise, iar citoplasmă deschide calea pentru materialul genetic străin.
Conducerea virion gripal:
HA - hemaglutinina, M2, - canal ionic, H - neuraminidaza, M1 - proteina coajă.
Pe suprafața hemaglutininei anvelopei virale este prezent ca trimeri. Fiecare din molecula sa este formată din două subunități: HA1 care asigură contactul primar cu celula țintă și FG2 responsabile de fuziune. În inițial neutru, condiție, (la pH 7) toate trimeri sunt orientate aproximativ perpendicular pe suprafața membranei, extinderea acestora
13 nm. Fiecare moleculă de HA este ferm ancorată în membrana sale și care este foarte important, este compus dintr-un scurt (25 de aminoacizi), peptidă care este la pH 7 este ascuns în interiorul trimerul și este localizat aproape de baza de proteine. După reducerea pH-ului 7-5 molecula de hemaglutinină rearanjat la nivel global și peptida de fuziune nu este pur și simplu merge liber și este mutat la capătul cel mai de sus al moleculei și pătrunde în membrana victimei.
Structura originalului hemaglutinină (pH 7) și stările active (pH5).
Culoarea marcată peptida de fuziune, care în mediul acid se schimbă configurația sa.
În molecula de hemaglutinina mediu neutru seamănă cu un arc fixat dispozitivul de blocare, care joacă rolul de peptide de fuziune, ascunse în „buzunarul hidrofob“ trimer. Dar este necesar pentru a scădea pH-ul la 5, ca o peptidă iese din captivitate și molecula HA poate merge la o nouă stare conformațională. Energia eliberată în acest sens, în conformitate cu măsurătorile destul de ridicate, dar încă nu suficient pentru convergența membranelor celulare și a virusului. Pentru a rezolva această problemă, moleculele de hemaglutinină nu acționează singur, ci în mod colectiv. Experimentele au arătat că în timpul interacțiunii virusului cu rozetele de celule țintă format din șase până la opt trimeri, în cadrul fiecăreia dintre care sunt porțiuni curbate lipidice cu o rază
10 nm. Cu ajutorul microscopiei electronice si studii electrofiziologice au descoperit astfel de edem local, cunoscut sub numele de Dimple [2].
Aici, pe vârfurile Dimple, începe reorganizarea lipidelor, ceea ce duce la formarea porilor de fuziune. Modelul teoretic al procesului [3] este după cum urmează: proteine de fuziune, membrana îndoind nu numai că le aduce mai aproape, dar, de asemenea, furnizează energie, facilitând formarea unei pânze de monostrat - urmăritor; monostraturi lipidice din deformează la distanță fără mari cheltuieli de energie. Ca urmare, noile structuri intermediare formate - intermediari de energie joasă, oferind fuziune.
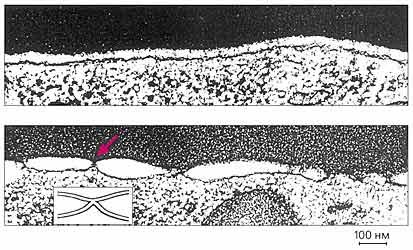
Formarea gropiță între membranele celulelor roșii din sânge și a celulelor care exprimă hemaglutinina.
Deasupra - limita membranelor eritrocitare și a celulelor care exprimă HA, pH 7,4;
în partea de jos - la fel, dar pH 4,9 - văzut un număr mare de regiuni de contact (săgeata colorată).
Diagrama insertie prezinta contactul.
Sub fuziune celulară, membrane virale sau organite celulare înțelese asociere volume limitate de apă și membrane ei înșiși. Pentru a monitoriza acest proces folosind un lipide etichete fluorescente solubile. Dacă o astfel de etichetă este inițial conținută în celulele A, apoi aparitia in celulele din fuziune a spus. Cu toate acestea, există momente când există o așa-numită polusliyanie, adică combina numai monostraturile de celule exterioare, convergența în contact localizate. Pentru a distinge între cazurile obținute și fuziunea completă, celulele sunt administrate un colorant solubil în apă. revărsare de la o celulă la alta indică o fuziune completă pentru a forma un por prin care comunicarea. Astfel, în experimentele pe explorarea masei de fuziune, de exemplu, într-o suspensie de virusuri și celule. Cu toate acestea, capacitățile acestei tehnici este limitată, cu greu de înțeles detaliile procesului, inclusiv formarea de contact localizate, apariția porilor și a dezvoltării sale. Astfel de probleme pot fi rezolvate numai cu utilizarea unei metode mai precise care să permită monitorizarea obiectelor unice, adică folosind tehnici de microscopie de fluorescență și electrofiziologie moderne. Acest lucru a fost realizat pentru prima dată în studiul exocitozei în celulele mast folosind tehnologia microelectronică.
Într-un tipic celule HAb2 eritrocitare experiment fuziune și acidularea soluției înconjurătoare la pH5 pori. Prin ea curge un curent capacitiv care încarcă celula roșii din sânge. Variația acestuia în timp reflectă extinderea porilor de fuziune. Simultan, membrana membranei eritrocitare în HAb2 curge colorant. Comparând cele două curbe (intensitate de fluorescență și de conducere) în funcție de timp, observați că al doilea cu mult în spatele primul. Se presupune că această întârziere de timp cauzate de trimeri proteina hemaglutinina din soclu, care formează un fel de barieră în calea fluxului sondei lipidelor. timpul inițial pentru fuziune este formată în gropiță lipidelor. În consecință, schimbarea compoziției lipidelor membranei poate afecta întregul proces. Când se apropie de bistraturile lipidice pot fi formate între monostraturile pod vecine (numite Peduncul) embrion pori viitoare. Probabilitatea formării sale depinde esențial de compoziția lipidelor. De exemplu, administrarea în monostraturi lizofosfatidilcolină (LPC), chiar și în concentrații mici de fuziune inhibat complet. Experimentele sunt deja HAb2-eritrocit a arătat că lizofosfatidilcolină este la fel de eficace ca și în sistemele lipidice modelului. Cu alte cuvinte, este timpul să fuzioneze după introducerea LPC nu apare deloc, cu toate că, judecând după apariția fluorescență, monostraturi sunt combinate.
Curbele de pori conductivitate (culoare) și intensitatea fluorescenței.
Mai sus - de control,
în partea de jos - același sistem, dar cu adaos de lizofosfatidilcolină.
Axa verticală - conductivitatea a lungul axei orizontale - timp.
Astfel, molecula HA este preparat jocuri de golf de lipide. Dar problema nu se limitează la acestea, o proteină implicată în etapele ulterioare. In anumite experimente, atunci când activitatea proteinei este redusă (de exemplu, scade gradul de acidifiere a soluției), în loc de fuziune completă și formarea porilor se produce polusliyanie, adică sonda lipidelor este redistribuit între celule, și nu există nici un curent. Aceasta înseamnă că, după formarea contactelor și formarea săritor de proteine pentru a efectua anumite lucrări necesare pentru apariția porilor. Aceste rezultate importante au fost obținute în grupul L.V.Chernomordika la National Institutes of Health (SUA), iar măsurătorile electrofiziologice sunt realizate în laboratorul nostru angajat V.A.Frolovym [4]. Rezultatele experimentelor in combinatie cu modele teoretice a permis sa ofere un anumit proces model de îmbinare care cuprinde patru etape.
procesul de fuziune Schema.
După scăderea pH-ului soclului de fuziune formate (1),
care promovează formarea de contact local a membranei (2)
și un jumper, care este apoi convertit în pori de fuziune (3, 4).
Cu toate acestea, orice model este întotdeauna diferit de obiectul real. HAb2 lipidelor membranei celulare are o compoziție diferită de membrana virionului, și este diferită densitate hemaglutinina și HAb2 celulă conține proteine M1 și M2. Dezvoltat în tehnica noastră de laborator ne permite să studiem fuziunea virionului cu o singură membrană bistratificată lipidelor [5]. Într-un mediu neutru (soluție tampon pH 7) sunt injectate virioni, dintre care unele sunt adsorbite pe bistratului. După aceea, membrana este presată micropipette plat este umplut cu o soluție de pH5. Deoarece vârful pipetei are o rază
1 mm, este posibil ca în interiorul acestuia, pe plasture lipidic, va fi una sau mai multe virioni, o membrană care este încorporată în concentrația sonda fluorescenta auto călire. Valoarea scăzută a pH declanșează fuziunea în interiorul pipetă și sonda este difuzată în bistratul. Rezultatele de diluție rezultați în fluorescență care pot fi detectate.
Configurația experimentală. A se vedea textul pentru detalii.
Măsurătorile electrice au arătat că, împreună cu sonda de flux lateral fluctuantă curentului electric apare care curge prin fuziunea porilor și orice structuri conductoare in membrana virusului. Experimentele speciale au dovedit că acesta este cazul în așa fel [6]. In aceste experimente, canalul ionic M2 blocat amantadina și acidificarea virionului a fost atinsă în scăderea pH-ului (5) în compartimentul inferior al celulei. Evident, pentru acest sistem experimental imediat după protonii de fuziune din compartimentul inferior trebuie să se grăbească prin deschiderea în timpul virionului care distruge învelișul proteic al M1 chiar și atunci când M2 blocate canale. Într-adevăr, în aceste condiții există activitate electrică, exact la fel ca și M2 cu canale deschise. Deci, în acest fel puteți monitoriza nu numai evoluția porilor de fuziune într-o membrană lipidică, dar, de asemenea, distrugerea rețelei de proteine. Acest lucru este extrem de important, deoarece randamentul de material genetic viral în citoplasmă este limitată atât coajă de protecție - proteină și lipidă.
Astfel, combinarea tehnicilor de microscopie electronica si electrofiziologie, am reușit să găsim contacte locale cu membrana (gropițe). Introducere lizolipida inhibă fuziunea biologică, ceea ce dovedește că primul proces intermediar, ca și în sistemele de model, servește un jumper (Peduncul).
Metoda dezvoltată de a studia o fuziune cu un singur bistraturi virionic lipidelor ne permite să investigheze cinetica procesului și modelul de îmbinare, care utilizează un mod fundamental noi intermediari care rezolvă problema „crizei energetice.“
Clarificarea rolului lipidelor și proteinelor în acest proces nu este doar un interes cognitiv. În viitor, este important pentru dezvoltarea de noi terapii antivirale.
Rezultatele au fost obținute în studii sprijinite prin subventii RFFI:
№93-04-20590, №96-04-50779, №99-04-48427 și №02-04-48287.
1. Chernomordik LV Melikyan, GB Chizmadzhev YA // Biol. membrană. 1987 Volumul 4. S.117-164.