Dupa ce a studiat acest subiect, trebuie:
- au o înțelegere a acestor concepte și fenomene:
- osmoză, presiunea osmotică (legea van't Hoff), rolul său.
- legea lui Raoult privind presiunea vaporilor de solvent deasupra soluției și schimbarea de fierbere și de congelare soluții (legea corolar Raoult).
Proprietățile coligative - sunt proprietăți care nu depind de natura particulelor de solut și depind numai de concentrația particulelor în soluție.
Proprietățile coligative ale soluțiilor diluate sunt:
- presiunea osmotică (van't Hoff)
- saturat la presiunea vaporilor de solvent deasupra soluției (Legea Raoult)
- Soluție de temperatură (1sledstvie din legea lui Raoult) fierbere
- Temperatura de cristalizare soluție (2 corolar al legii lui Raoult)
Proprietăți nonelectrolytes
Osmoza numita mișcare spontană a moleculelor de solvent printr-o membrană semipermeabilă dintr-o soluție la o concentrație în soluție de concentrație mai mare. Ca rezultat, apar scurgeri osmoză presiunea osmotică a soluției. soluție hipertonică numită soluția în care presiunea osmotică este mai mare. soluție hipotonă - o soluție cu o presiune osmotică mai mică. soluții izotonice - o soluție cu aceeași cantitate de presiune osmotică.
Celula vegetală (C>) (soluție intracelulară)
Mediul extern (C <) (межклеточный раствор)
Van't Hoff, studiind dependența presiunii osmotice a factorilor externi a constatat că aceasta nu depinde de natura solutului și depinde numai de numărul de particule în soluție și la temperatura:
Rosma = SMRT. în care Rosma [kPa], T [K] - temperatura, R = 8,32 kJ / mol absolut - constanta universală a gazelor, See - concentrația molară a soluției [mol / l].
Presiunea osmotică a unei soluții care conține mai multe substanțe este suma presiunii osmotice cauzată de fiecare dintre ele.
Presiunea vaporilor saturați deasupra soluției (Legea Raoult):
scăderea presiunii de vapori saturați deasupra soluției relativ este direct proporțională cu fracția molară a solutului:
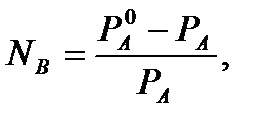
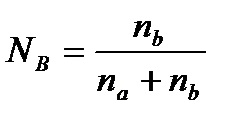
Cea mai mare valoare practică a primit I, II consecință a legii lui Raoult.
Am consecință a legii lui Raoult. Creșterea temperaturii de reflux a soluției este direct proporțională cu concentrația molară a substanțelor dizolvate: Dtkip = KEB. Cm. unde încălzit Dtkip = t r-ra - t refluxare H2 °, 0 C; Keb - ebulioskopicheskaya constant solvent (Keb H2O); concentrația de molal de solvent solut SM mol / 1000g.
consecință a II-a legii lui Raoult. scăderea temperaturii de congelare a soluției este direct proporțională cu concentrația molară a substanțelor dizolvate: Dtzam = KKR. Cm. în cazul în care Dt = t zam.n2 despre - t ra district adjunct. 0 C; Kkr - constanta solvent cryoscopic (Kcr H2 = circa 1,86); concentrația de molal de solvent solut SM mol / 1000g.
A se vedea Rosma = R T = Dtkip Cab Dtzam Cm Cm = Kcr
Proprietățile coligative de soluții pentru moleculare
Notă: A se vedea Anexa 7 - „constantele cryoscopic ale unor solvenți,“ Anexa 8 - „Constantele Ebulioskopicheskie ale anumitor solvenți.“.
Aceste ecuații sunt valabile numai pentru soluții în care nu există nici o interacțiune între particule, adică, pentru soluții ideale. Soluțiile reale apar interacțiuni intermoleculare între moleculele substanței și un solvent, care poate duce la disociere sau a proceselor sau a proceselor de asociere moleculară. Disocierea moleculelor substanței în soluția apoasă este caracteristic pentru electroliți puternici. Ca rezultat al disocierii numărul particulelor crește.
Ratio (i) particulele produse este definit ca fiind raportul dintre numărul total de particule la numărul inițial de molecule. Depinde de gradul de disociere a electrolitului și numărul de particule în care molecula:
i = (n-1) a + 1. i - numitul coeficient izotonic. n - numărul de particule (ioni), în care molecula, un - grad de disociere (în fracțiuni).
Rosma ism R T = Dt = i Cab încălzit Dtzam Cm Cm = i Kcr
Proprietățile coligative ale soluțiilor de electroliți
Exemple de fierbere calcule, congelare, soluții presiunii osmotice de diferite concentrații.
Exemplul 1. Se calculează punctul de congelare, soluție de etanol la fierbere, cu o concentrație de interes (w), egal cu 40%.
Soluție: calculul punctului de congelare soluție II, pe baza legii lui Raoult anchetei: Dtzam = Kkr. Cm, cu toate acestea, pentru a răspunde necesității de a trece de la o specie la alta concentrație:
w [m în insule, r \ r-ra 100g] ® Cm [n moli \ 1000 g de p-la]
1. proceda în greutate vesch Insulele (m) la moli de (n) prin proporție:
1 mol de C2 H5 OH ------- conține 46 g
sau prin formula x (n) = = mol / 100R-pa
2. proceda prin greutatea soluției la greutatea solventului:
m p = A p m-ra - m în insule = 100-40 = 60 g p-la
2. O proporție de expres Cm:
0.87 moli de C2 H5 OH conține 60 g solvent
x (Cm) = 14,5 mol / 1000g p-la
4. Formula Dtzam = Kkr. Cm găsi Dt: Dt = 1,86. 14,5 0 C = 26,97
5. Dt = tzam H2O - tzamr Dl. Þ tzam r-ra = tzam H2O - Dt = 0 - 26,97 -26.97 0 = C - congelare temperatură soluție de etanol 40%.
Calculăm punctul de fierbere soluție I, pe baza legii lui Raoult anchetei: Dtkip = Keb. Cm, Cm = 14,5 mol / 1000R medie (cm. Deasupra)
Din formulă vom găsi Dt: Dt = 0,516. = 0 7,48 14,5 C
Dt = tkipr-ra - punctul de fierbere H2O Þ B.P. pa = p-H2 B.P. aproximativ 100 + + = 7.48 = 107.48 0 C la fierbere soluție de etanol Dtkip 40%.
Exemplul 2. Se calculează concentrația de ser fiziologic (NaCl) izotonic cu presiunea osmotică a sângelui egal cu „800 kPa. Gradul de disociere de NaCl ia 90%.
Soluție: Pentru soluții electrolitice Rosma (NaCl) = i · vezi · R · T Þ
Condiții izotonicitatea înseamnă Rosma (NaCl) = = 800 sanguin Rosma kPa,
i = (n-1) · a + 1 = (2 - 1) · 0,9 = 1,9
NaCl Û Na + + Cl -. unde n = 2, a = 0,9
Substituind valorile obținute în formula (1) A se vedea = 0,17 mol / litru - concentrație de clorură de sodiu, care creează o presiune osmotică de 800 kPa.