Chimie și Inginerie Chimică
Această metodă se bazează pe faptul că după încetarea circuitelor instantanee de inițiere fotochimică în reacțiile de oxidare pentru ceva timp există reducere a concentrației de radicali peroxil la o valoare corespunzătoare reacției de întuneric. care poate fi detectat printr-o scădere a intensității chemoluminiscență. Chemiluminescența aftereffect Metoda fotochimic diferită de metoda de mai sus-TION discutată de aftereffect fotochimic singura modalitate de a măsura viteza de reacție în timpul perioadei de stabilire a unei noi concentrație la starea de echilibru a radicalilor peroxidici, într-un caz masurat rata de absorbtie de oxigen. într-un alt [c.307]
Intensitatea chemoluminescente [PLA], și egală cu [c.106]
În alte cazuri, o astfel de energie electronică ar trebui să degenereze, ca urmare a coliziunilor inelastice în alte forme de energie - de obicei, energia vibrațională. De regulă, statele electronice. format ca rezultat al reacțiilor chimice. metastabilă. astfel încât ne putem aștepta ca starea excitată electronic își pierd energia în exces într-o coliziune. Cazuri rare de tranziții permise sunt responsabile pentru procesele care se referă la reacțiile de chemiluminiscență. [C.342]
Trimolecular di- reacție de recombinare și particulele trihidrici în fază gazoasă joacă un rol important în unele reacții în lanț. Circuit deschis în volum, și un număr de alte procese (fenomene atmosferice, chemiluminiscenta și colab.). Informații despre aceste reacții, în general, au început să se acumuleze în ultimii ani, [207-210]. Cele mai atent studiate pe larg reacția dintre N ch Ga + M> Noe + M, care joacă un rol important în cinetica proceselor chimice complexe. [C.124]
Atunci când probabilitatea de reacție (2,9) decât pentru reacțiile (2.10) și (2.11), observat chemiluminiscenta. [C.33]
amestecuri de hidrocarburi Inflamarea Conditii de mediu datorită proceselor complexe mecanismului preaprindere lanțului de dezvoltare poate fi mono- sau mai multe etape, în funcție de mediul de temperatură și presiune și structura hidrocarburilor. componente ale amestecului. În anumite condiții, aprindere (cald explozie) mix normal poate precede apariția așa-numitei flacără rece - etapă intermediară specială a procesului de oxidare. însoțită de o creștere relativ mică a temperaturii (aproximativ 100 ° C) și o strălucire slabă albastru-violet vizual perceptibil numai în întuneric. Se crede că cauza emisiei de chemiluminescență este cauzata de molecule excitate de formaldehidă. Rece auto-încălzire a amestecului combustibil detectat în mod clar atunci când studiază, de asemenea, în bomba - o diagramă caracteristică salt pe afișaj [18]. [C.55]
Aceste constatări sunt în concordanță cu teoria numeroaselor date experimentale privind distribuția de energie a produselor de reacție. obținut prin chemiluminescență IR [170, 455, 527] și fotoliza bliț 1440]. [C.144]
În unele sisteme, cu toate acestea, atunci când este administrat inhibitorul de intensitate chemiluminescență nu scad, dar crește. Astfel, atunci când este administrat într-un ciclohexanol oxidantă și naftilamină amplificată strălucire chemiluminiscent [190]. Studiul a demonstrat ca luminescenta este îmbunătățită prin introducerea aminelor aromatice într-un sistem în care radicalii generat de peroxid prezent și moleculele polare (alcool, cetonă, eter, etc.). [C.106]
Spectrele de chemiluminescență împreună cu benzile de rotație-vibrație sunt benzi și linii asociate cu excitație electronic [44 observate uneori. 143, 581]. [C.143]
de terminare a lanțului pătratică viteză constantă în reacțiile de oxidare a compușilor organici pot fi determinate folosind metode bazate pe măsurarea chemiluminescenței, care însoțesc aceste reacții. Luminiscența care apare în timpul oxidării substanțelor organice în faza lichidă. datorită recombinării radicalilor de peroxid și COG se observă în regiunea vizibilă a spectrului de la 400-600 nm. Intensitatea chemiluminescență este foarte mică, și poate fi măsurat cu dispozitive fotovoltaice extrem de sensibile. [C.306]
flăcări cool. Atunci când este încălzit amestecuri combustibile au uneori așa-numitele flăcări la rece. Ei interacțiune chimică conduce la apariția unui luminescenta care nu este asociat cu încălzire, și reprezintă un chemiluminiscentei (în regiunea vizibilă. Cm. Anexa 1). Încălzirea într-un mediu de combustibil [C.28]
Mai sus (p. 16) stipulează că posibilitatea unei intense chemiluminescență unor flăcări destul de rapid, nu sunt luate în considerare. [C.42]
Pentru procesele fotochimice se referă, de asemenea, luminiscență, care este împărțit în fluorescență (fotoluminescență), fosforescență și chemiluminiscenta. [C.363]
În consecință, după alimentarea cu oxigen într-o hidrocarbură ce conține inițiator, pentru o creștere a timpului în intensitate chemiluminescenței vor fi observate în cazul în care z dq, la / (a /. Corespunzătoare staționare [c.309]
Astfel, curba cinetică a intensității chemoluminescente după saturația de hidrocarbură instantanee kis- [c.310]
Fig. 85. Cinetica chemiluminiscentei Fig. 86. Curba anamorfoză după o oxigenare sistemică rapidă Fig. 85
Comportamentul ulterior al particulelor excitate este independentă de mecanismul de formare. Posibila călire fizică sau chimică a luminiscență, transferul de energie către alte particule sau dezactivarea radiationless intramoleculară. Dacă durata de viață a unei particule excitat este mică în comparație cu timpul de relaxare, poate fi decontaminat cu emisia unui foton (Fig. 42), t. E. chemiluminiscenta. În funcție de mecanismul de formare și natura chimioluminiscenta particulelor excitate poate fi fluorescență sau fosforescență. După cum se poate observa din Fig. 42, chemiluminiscenta energie fotonică egal / IV a + C, unde a - energia de activare Q - căldura eliberată în caz elementar. În consecință, chemiluminiscenta trebuie respectate în gama de lungimi de undă corespunzătoare. În unele reacții în fază gazoasă se observă chemiluminiscenta în infraroșu corespunde excitarea vibratorie a moleculelor. Reacțiile au loc în faza lichidă. energia de excitație vibrationala este disipată foarte repede. Emisia de chemiluminescență observată corespunde în general cu glonte nivel de vibrație al stării electronice excitat și este mai puțin în regiunile vizibile și ultraviolete. [C.119]
Din păcate, această secțiune nu este suficient luată în considerare posibilitatea utilizării eficiente în studiile cinetice snektroskopi-agenții și metode spectroscopice de masă. și aplicarea cinetică metoda trasor. Metode de chemiluminiscență, electroni de rezonanță paramagnetică (EPR), calorimetrie separat în timpul proceselor omogene eterogene. Aceste metode au fost aplicate cu succes și a primit o dezvoltare semnificativă în URSS. Cu ajutorul lor o mulțime de informații obținute cu privire la mecanismul detaliat al complexului, în lanț special, reacții. [C.6]
O examinare detaliată a problemei - este mai degrabă un tribut adus istoriei dezvoltării cineticii chimice. mai degrabă decât o nevoie urgentă de cinetica zilei. Având în complexul reacției în fază gazoasă. Benson subliniază că hotărârea mecanismului de reacții care implică radicalii liberi și atomii trebuie să se bazeze în mare parte pe dovezi indirecte. În prezent, din ce în ce poziție în schimbare - în special în legătură cu progresul metodelor aplicare EPR, chemiluminiscenta, inhibitori etc. [C.6].
Made in ultimii ani, studiile au rece strălucire folosind instrumente extrem de sensibile a relevat că reacțiile chemiluminiscenta ale hidrocarburilor datorate reacției de recombinare diferite de oxidare a radicalilor liberi, inclusiv peroxid produs în dezintegrarea moleculei inițiator - hidroperoxid. azoizobu-tironitrila, diciclohexil și colab. [23]. Evident, chemiluminescența este o proprietate generală a radicalilor liberi (compuși care au o energie de aprovizionare neskompensiro chimice baie) manifestată când se formează un rezultat al recombinării moleculei de recombinare M, care este într-o stare excitată [C.33]
energia este insuficientă pentru chemiluminiscenta interesant, deoarece lungimile de undă duble D-mmmi sunt sodiu 5889.96 5895.93 A și A, ceea ce corespunde la aproximativ 48,300 kal1mol. Rezultat atom de iod poate atom soedts-nitsya de sodiu [c.137]
Chemiluminescența în oxidarea inhibată. Hemilyu-luminescență provine din dispronortsionirovaniya radicali peroxil secundari [31] când oxidarea zhpdkofaznom a hidrocarburilor. În această reacție, cetona se formează într-o stare triplet excitat. O parte cetonă moleculele excitat emit fotoni de lumină. care este motivul pentru care chimico-luminescenta. Mecanismul chemiluminescența poate fi schema [c.106]
G1 [KOg-]. unde m] - probabilitatea de emisie a luminii cuante per 1 + K02- act K0g-. Atunci când este administrat inhibitor în viteza de reacție de hidrocarbură oxidat COH - scade gKOg- sa, ioetomu intensitatea chemiluminiscenta scade. Dependența I [1PN] când aproape toate circuitele pauze inhibitor descris de formula [c.106]
Există măsurarea directă a distribuției intensității în spectrele diferitelor părți ale flăcării, care implică lipsa de echilibru în zona de reacție. La radiație zonă de reacție neechilibru indică, de exemplu, că, în multe flăcări sunt prezente în flacără strălucire Yarte atomii de metal în zona de reacție. decât în părțile învecinate ale flăcării [592]. Adăugați că intenția spectrului intensității radiației Bunsen plamepi când suficientă nokaza.sh vo.zduha (a se vedea. [291, p. 197]), care până la 20% din căldura de reacție necesară asupra ieluknve în regiunea IR și mai puțin de 0,4% - la o fracțiune din lumina vizibilă și UV. Rețineți că izluchepie IR nlamen la cald reprezintă în principal termolyuminsstseitsiyu, spre deosebire de emisie de chemiluminiscență și care este regiunile vizibile și UV. [C.234]
Reacția chimică, în unele cazuri, datorită apariției de radiații specifice a căror intensitate nu poate depinde de temperatura. În acest caz, energia chimică a mediului de reactiv este transformată direct în energie radiație. ocolind etapa a corpului de încălzire izlugayuschego. O astfel de radiații este numit chemiluminescență. Intensitatea chemiluminescența, în principiu, nu este limitat și poate fi substanțial mai mare decât cea a radiației termice. [C.110]
Fig. 82. Aparat pentru studierea fotoposledeystviya folosind chemiluminescență

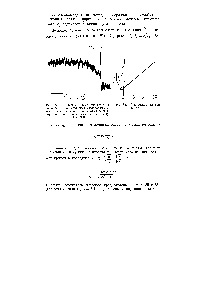
Fig. 83 przdstavlena curba cinetică de cădere de intensitate de chemiluminescență în oxidarea cumenului la 20 ° C după încetarea iluminării. Fig. 8 este anamorfoză această curbă în coordonate (Y / d // - 1), t. Panta liniei este egal tga = 4,4-10 așezat -, rata de circuite de inițiere fotochimice în aceste experimente este [c.308]
Fig. 85 prezintă curba cinetică chemoluminescente în etilbenzenului la 36 ° C cu un inițiator, după oxigenare rapidă. salt abrupt clar vizibil la veli1 intensitate chemiluminiscenta [ins / după intrarea oxigenului conectată cu atașament practic instantanee [c.310]
Chemiluminescență este diferită de natura fotoluminescentei numai etapele de formare a particulelor iozbuzhdennyh. În cazul în care molecula fotoluminescentei IRI intră într-o stare excitată prin absorbția energiei radiației incidente, atunci molecula hemilyumines-tsentsin este entuziasmat de conversie a energiei de energie chimică în caz elementar de excitație. Cea mai simplă schemă de reacție însoțită de chemiluminescență, [c.118]