Secvența de aminoacizi nu este singurul factor care determină forma moleculei de proteină. In celula, exista molecule speciale, care sunt implicate în mod activ în plierea proteinelor.
In mod colectiv moleculă implicată în plierea proteinelor numite regulatoare, printre care secreta mai multe tipuri de pliere. Molecule care accelerează plierea, catalizatorii de pliere menționată. Molecule care servesc pentru a schimba forma de proteine - pliere chaperones. Există patru tipuri de molecule care joacă un rol de chaperones.
1. Moleculele responsabile pentru corecta pliere a proteinelor (pliere proteine chaperone - Chaperones pliere).
2. Moleculele create pentru a fixa molecula de proteină parțial pliată într-o anumită poziție. Este necesar ca sistemul a fost capabil să completeze plierii (Chaperones holding - holding chaperones).
3. Chaperones proteinelor cu desfășurare formă neregulată (dezagregarea Chaperones - Chaperones dezagregare).
4. Chaperones proteine însoțitoare sunt transportate prin membrana celulară (Chaperones secretorii - chaperon secretorii).
chaperones Folding pentru a ajuta veveriță să ia o conformație corectă. Multe dintre ele sunt zaharuri mici sau peptide. Imaginați-vă linia de asamblare în producție. In timp ce produsul se deplasează de-a lungul liniei de asamblare, puteți încorpora în unele dispozitive temporare, cum ar fi capse și nituri pentru a menține o anumită formă pentru mai multe etape de asamblare. La finalizarea acestor pași, restricții pot fi eliminate. În următoarele etape de asamblare, poate fi nevoie dispozitive de reținere suplimentare, care vor fi eliminate la ieșirea produsului finit. pliante de mici dimensiuni a actului chaperone molecula ca nituri și capse în linia de asamblare menținând în același timp articol în configurația corectă necesară pentru a finaliza pasul următor. În cazul în care proteinele au o formă neregulată, acestea nu îndeplinesc funcția lor inerente, sau se vor acumula agregate insolubile, cunoscut sub numele de incluziune.
În interiorul celulei conține o cantitate mare de apă. Molecule în el, de obicei, încărcat, adică sunt hidrofile. molecule neîncărcate, după cum ne amintim, sunt hidrofobe. Într-o secvență lungă liniară a proteinei sunt regiuni hidrofile și regiunile hidrofobe. In mediu apos proteina de suprafață celulară hidrofobe tind să fie în interiorul moleculei de proteină, expunând regiunile hidrofile afara unde pot interactiona cu moleculele de apă. Funcția de molecule mici chaperone plierea proteinelor este în interacțiunea cu suprafețele de proteine hidrofobe, încărcându-le sau, invers, acoperind câmpul încărcat care permite proteinei să ia forma corectă. Prin adăugarea și eliminarea acestor molecule a celulei determină când și modul în care porțiunea hidrofobă a proteinei ar fi în interiorul moleculei de proteină. Aceasta determină forma proteinei (fig. 8.6).
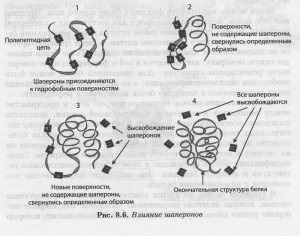
Fig. 8.6. Influența chaperones
Chaperones Imobilizarea se leaga de proteine, care joacă rolul unui rezervor al acestor proteine, atâta timp cât chaperones pliabile nu sunt scutite și nu încep să lucreze cu aceste proteine. Imobilizarea proteine chaperone se menține în condiții de stres chimic și termic, atâta timp cât condițiile din interiorul celulei nu devine mai favorabilă pentru plierea corecta de proteine. Acesta este unul dintre mecanismele pe care celula le utilizează pentru a preveni plierea defectuoasă. Un alt mecanism este legat de funcționarea chaperones dezagregare. Dezagregarea Chaperones transportate replierea proteinelor a căror pliere a fost efectuată corect. Acestea sunt realizate într-o celulă, un rol important de supraveghere în colectarea și reciclarea materiilor prime secundare. În ciuda existenței acestor mecanisme, un anumit procent de proteine celulare încă cade în grămada de gunoi, adică, forme de incluziune insolubili. Incluziunile sunt observate în celulă sub forma unor mici grupuri dense.
Una dintre caracteristicile chaperones, pe care le-ar găsi deosebit de important este faptul că acestea sunt relativ non-specifice. Cu alte cuvinte, Chaperone molecula plierea ar transporta mai mult de o proteină. Cercetatorii studiaza cauzele misfolding proteine, celule rănite accidental găsit în molecule cu structură similară cu chaperones. Ei au descoperit molecule care corectează efectele misfolding proteine. Pe baza caracterului universal al chaperones, puteți introduce diferite chaperones in sistemul Bioinginerie si interfera cu proteina corespunzătoare de pliere într-un mediu în care nu ar avea loc altfel. Crearea chaperones specializate responsabile pentru plierea proteinei recombinante (bio-inginerie) - se dezvoltă foarte activ domeniu de cercetare Bioinginerie.
Proteina de pliere poate fi supus la mai mult de o dată. Imaginati-o proteina care este destinat pentru primirea în membrana celulei, adică este o proteină de membrană integrală. Proteina produsă în citoplasmă celulei și apoi transportate spre membrana plasmatică. Astfel de proteine trec prin membrana, și fixată în aceasta se formează pe structura receptorului său de suprafață. Pentru transportul proteinei poate fi necesară, una dintre conformației sale, în timp ce chiar înainte de introducerea în proteina membranei este repliată.
În spațiul periplasmatic, adică în spațiul dintre membrană și membrana celulelor bacteriene sunt chaperone care asigură pliere și inserția în membrana proteinelor membranare integrale. În celulele eucariote, majoritatea modificărilor post-translaționale ale proteinelor indreptate la exporturile lor și încorporarea în membrana plasmatică. Astfel de modificări ale proteinelor apar în lumenul aparatului Golgi și reticulului endoplasmic. Aceste organite sunt destinate depozitării și modificarea proteinelor.
Secreția de proteine din celulele implicate alt sistem de control care include un chaperone secretorie. Chaperones secretorii recunosc secvența semnal de aminoacizi, care este numit în mod corespunzător secvenței secretor. Această secvență se leagă la Chaperone secretorie, un chaperone intra in membrana, oferind proteinei cu un export.